6-OHDA으로 유도한 파킨슨병 모델에서의 선퇴추출물의 행동장애 및 도파민 세포 사멸 억제 효과
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Parkinson's disease (PD) is the second most common neurodegenerative disorder, characterized by dopaminergic neuronal loss in the substantia nigra, resulting in reduced dopamine levels and consequent motor dysfunction. Genetic and environmental factors contribute to oxidative stress in PD. Cicadidae Periostracum (CP), a traditional Korean medicine, has shown neuroprotective effects against MPTP-induced neurotoxicity in PD. However, its effects on the 6-hydroxydopamine (6-OHDA) model have not been established. This study examined CP's effects on a 6-OHDA-induced PD model. CP protected against 6-OHDA damage in both in vitro and in vivo studies. Furthermore, CP reduced the production of reactive oxygen species, inhibited apoptosis, preserved dopamine levels, protected tyrosine hydroxylase in the substantia nigra, and improved motor function. These findings suggest that CP may delay PD progression by maintaining the redox balance.
Keywords:
Cicadidae Periostracum, 6-hydroxydopamine, Parkinson’s disease1. 서 론
파킨슨병(Parkinson's Disease, PD)은 신경퇴행질환에서 두 번째로 흔한 질병으로 알려져 있다 (Poewe et al., 2017). 뇌흑질 (Substantia Nigra; SN)의 도파민계 신경이 소실됨으로써 신경전달물질인 도파민의 양이 감소되고, 이에 신체 떨림 및 경직, 느린 운동, 자세 불안정과 같은 행동장애가 나타나는 특징을 나타낸다 (Poewe et al., 2017). 아직까지 명확한 기전은 밝혀지지 않았으나, 중금속, 농약, 일산화탄소 등에 의한 산화스트레스 생성을 포함한 protein deglycase/Parkinsonism associated deglycase (PARK7) 등 유전인자의 변형이 주원인으로 보고 되고 있다 (Uversky et al., 2001; Poewe et al., 2017; Dorsey et al., 2023). 현재까지 치료제로는 감소된 도파민의 양을 증가시키기 위한 대증요법제로서 L-3,4-dihydroxyphenylalanine (L-Dopa)가 일반적으로 사용되고 있다 (Poewe et al., 2017). L-Dopa는 사용 후, 파킨슨병의 진행을 더디게 하고 임상증상의 경감을 보이지만, 장기간 복용 시 불수의적인 운동, 구토 등의 부작용이 따른다고 보고 되고 있다 (Poewe et al., 2017; Schneider et al., 2017). 그 외에도, 도파민의 리셉터를 활성화 시켜주는 dopamine agonists 및 도파민의 대사를 조절하는 catechol-O-methyltransferase inhibitor (COMT inhibitor), monoamine oxidase B (MAO-B inhibitors) 등과 같이 다양한 기전의 약물이 존재한다 (Poewe et al., 2017; Schneider et al., 2017). 그러나 최근까지 이러한 약물들을 장기 복용 시 부작용 및 다양한 합병증이 유발된다는 보고가 발표되고 있으며, 이를 최소화 하는 의약품 또는 대체 할수 있는 약물의 개발이 필요한 실정이다.
선퇴는 매미과에 속하는 매미의 유출이 성충으로 변화 할 때 탈피한 껍질로 동의보감에 따르면, 임상학적으로 소아의 경련, 발열, 파상풍, 담마진, 피부염 등에 사용있다고 수록되어 있다 (Lim et al., 2019, 2022). 최근 우리 연구진은 도파민세포 분화에 중요한 역할을 하는 nuclear receptor-related factor 1 (Nurr1) 유전자의 활성을 증대시켜 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) 신경독성으로 유도된 파킨슨병 억제 효과에 대한 효능을 최초로 검증한 바가 있다 (Lim et al., 2019, 2022). 본 연구에 따르면, Nurr1은 도파민세포의 분화에 있어 중요한 역할을 하고 있어, Tyrosine Hydroxylase (TH), DOPA decarboxylase와 같은 도파민을 생성하는데 필수적인 중간 효소들의 양을 늘리는 것을 알수 있었다 (Lim et al., 2019). 뿐만 아니라, 항염증, 항세포사멸 등 Nurr1 활성에 의한 긍정적인 효과를 교차 확인 할수 있었다 (Lim et al., 2019). 이번 연구에서는 이전연구에서 밝혀진 결과를 바탕으로 6-hydroxydopamine hydrobromide (6-OHDA)으로 유도된 파킨슨병 세포 및 동물 모델을 활용하여 선퇴의 효능을 검증하였고, 이는 향후 항파킨슨병 치료제 개발에 있어 다양한 형태의 질환 모델을 활용한 선퇴의 효능 확인으로 중요한 근거가 될 것으로 사료된다.
2. 재료 및 방법
2.1. 재료 및 시약
Roswell Park Memorial Institute (RPMI), fetal bovine serum (FBS), penicillin/streptomycin (P/S)은 Gibco Industries Inc. (Auckland, NZ)에서 구입하였다. Dimethyl sulfoxide (DMSO), 3-(4,5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide (MTT), 6-OHDA, vectashield mounting medium, phosphate buffer saline (PBS) 등은 Sigma-Aldrich사 (St. Louis, CA, USA)에서 구입하였다. 또한, Labor Diagnostika Nord사 (GmbH, Nordhorn, Germany)의 dopamine concentration ELISA fluorometric assay kit (#BAE−5300)를 활용하여 측정하였며, 실험에 사용한 시약들은 일반적인 상세 분석용 등급 이상급으로 사용하였다. 본 실험에 활용된 CP (KIOM-3-18-0038)의 약물동정 및 추출 등의 제조는 이전 발표 논문에 따랐다 (Lim et al., 2019, 2022).
2.2. 세포 배양 및 세포 독성 평가
세포 실험 방법은 이전 논문에 상세하게 기술되어 있으며 (Lim et al., 2019, 2022), 아래와 같이 간략하게 서술하였다. PC12세포 (KCLB No. 21721)는 37℃의 5% CO2, 95% 조건에서 10% FBS, 1% P/S를 포함하는 RPMI 배지를 사용하였다. 96-well plate에 PC12 cell은 1.0×104/well로 seeding하고 2일 간격 새미디어를 바꿔주었으며, NGF를 7일간 투약하였다. 그 후, CP추출물 0.01-200 µg/mL 농도별로 1시간 동안 전처리 후 23시간 6-OHDA (in 0.2% ascorbic acid in PBS)를 함께 처리하였다. 반응이 끝난 후 상층액 제거한후 MTT 시약을 2시간 처리 후 DMSO를 이용해 decrystallization시켜 activity를 측정하였다.
2.3. ROS 측정
ROS는 H2DCF-DA를 사용한 fluoresecence를 측정하였다. PC12세포에 0.01~200 µg/mL 농도별로 1시간 동안 전처리 후 1시간동안 6-OHDA (in 0.2% ascorbic acid in PBS)를 함께 처리하였다. 그 후 20 µM H2DCF-DA를 넣어 30분간 추가로 배양하였으며, PBS 세척 후 fluoresecence excitation 495 nm, emission 530 nm로 측정하였다.
2.4. 사육과 투여
ICR 생쥐 8 주령을 두열바이오텍에서 구입하였고, 사료와 물은 자유 섭취를 하도록 하였다. 본 실험은 한국한의학연구원 동물실험 윤리위원회의 승인을 받아 진행하였다. 제1군 (대조군, n=7) 및 제2군 (6-OHDA군, n=7)은 식염수를 5 일간 1일 1회 경구 투여하였고, 제3, 4군 (CP 투여군, n=7)은 식염수에 용해시킨 CP를 100 또는 200 mg/kg으로 5일간 1일 1회 경구 투여 (100 μL)하였다. 본 연구에서는 뇌정위수술법을 활용하여 6-OHDA (in 0.2% ascorbic acid in PBS)을 투여하였다. TMB을 활용하여 복강 내에 주입하여 마취를 시행하고, 뇌정위 수술틀 (sterotaxic frame)에 머리를 고정하였다. 두피에 약 15 mm수직으로 절개하여 bregma를 기준으로 전방 0.5 mm, 측방 2.5 mm되는 곳에 드릴로 구멍을 뚫고 그 부위에 10 µL용량의 Hamilton syrige 주사침을 경막으로부터 5.5 mm깊이로 수직 주사 후 분당 0.5 µL의 속도로 총 3.0 µL의 6-OHDA을 주입하였다. 주입 후 5분을 대기 후 서서히 주사핌을 제거 및 두피 봉합을 실시하였다.
2.5. 행동평가
PD의 운동기능 장애를 확인하기 위해 pole test을 실시하였다. 높이 55 cm, 지름 8 mm의 막대를 제작하여 그 위에 마우스를 올린 후 마우스가 몸을 돌리는 시간값 (time to turn (T-turn))과 내려오는 시간 값 (time for locomotion activity (T-LA))을 측정하였다. 각 실험은 3회 연습 후 2회 본 실험의 평균값을 사용하였다.
2.6. 도파민 및 TH 측정
6-OHDA 투여 7일 후 경추탈골을 통해 희생시켰으며, 뇌조직 내 선조체 및 흑색질을 확보하여 –20°C에 보관하였다. 이후 dopamine concentration ELISA fluorometric assay kit와 TH assay kit를 활용하여 메뉴얼에 따라 실험을 진행하였다.
2.7. 통계처리
모든 측정값은 mean ± S.E.M으로 표시하였다. 본 연구의 통계처리는 Graphpad Prism 5.0 (San Diego, CA) 프로그램을 사용하였으며, one-way ANOVA를 이용하였으며, 사후검정은 Tukey’s test를 이용하여 평균값의 유의성을 5 % 미만의 한계로 조사하였다.
3. 결과 및 고찰
3.1. 6-OHDA 신경독성에 대한 CP의 신경세포 보호 효과
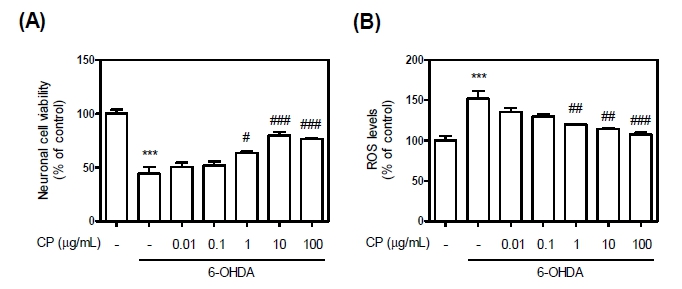
본 연구진은 CP가 신경세포에 미치는 영향을 평가 하기 위해 신경독성인 6-OHDA을 활용한 산화스트레스 생성 모델을 제작하여 확인하였다. 6-OHDA 처리 시 23시간 후 44.47%로 신경세포 생존율이 감소하는 것을 확인할수 있으며, CP처리 시 농도 의존적으로 76.68%까지 예방 또는 회복되는 것을 확인할 수 있다(Fig.1A). 뿐만아니라, 6-OHDA의 ROS 생성율을 확인해 보았을 때, 6-OHDA 처리 시 151.99%까지 증가된 ROS가 CP처리 시 농도 의존적으로 107.70%까지 감소하는 것을 확인할수 있다(Fig.1B). 따라서, 신경세포의 사멸은 6-OHDA에 의한 증가된 ROS에 영향력으로 판단될 수 있다.
3.2. CP에 의한 도파민 함량 증가 효과
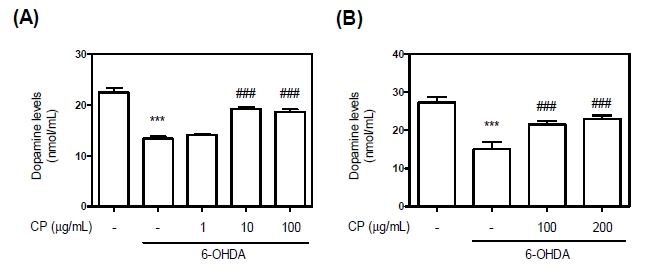
다음으로 파킨슨병에서 가장 중요시 여겨지는 신경전달물질인 도파민의 생성정도를 확인해 보고자 6-OHDA 유도 파킨슨모델을 활용하여 평가하였다. in vitro와 in vivo 모델에서 6-OHDA 신경독성에 의해 도파민 함량이 59.42%, 55.29%로 감소되는 것을 확인할 수 있으며, 이는 CP에 의해 농도의존적으로 82.79%, 84.37%로 유지시키는 것을 확인할 수 있다(Fig.2).
3.3. CP에 의한 도파민 생성 효소 TH 증가 효과
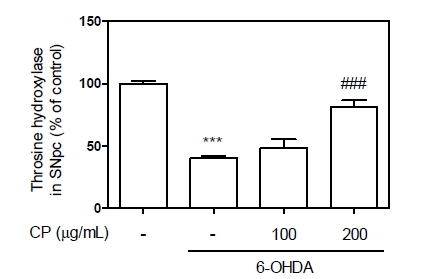
도파민은 tyrosine으로부터 시작하여 TH효소에 의해 L-DOPA를 거쳐 생성되는데, 이는 TH 효소의 증가률 증가된다는 것이 도파민의 양이 증가시킬수 있다고 생각될 수 있으며 TH의 경우 Nurr1의 하위인자로 활성 증대에 따라 그 양이 증가될 수 있다고 많은 보고가 되어져 있다 (Lim et al., 2019, 2021). 따라서, 우리는 이전연구의 결과를 활용하여 Nurr1이 증가됨에 따른 TH의 증가 가설을 세웠고, 본 연구에서는 6-OHDA 모델을 활용한 감소된 TH에 대한 CP의 영향을 평가해보았다. 그 결과, 6-OHDA에 의해 40.09%로 감소된 TH가 CP에 의해 81.42%까지 보호하는 것을 확인하였으며, 이는 도파민의 양을 유지시키는데 큰 역할을 했을 것으로 추측할 수 있다(Fig.3).
3.4. CP의 세포사멸 신호전달 억제능 확인
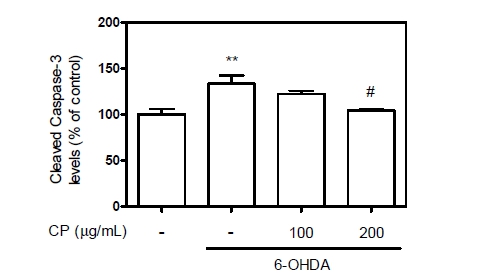
우리는 in vitro 실험 결과를 비준했을 때, 도파민 함량의 감소와 함께 도파민성 신경세포의 사멸이 함께 진행되었을 것이라 생각되어 6-OHDA 동물모델에서의 SNpc에서 apoptosis에 중요한 역할을 하는 cleaved caspase-3를 측정해 보았다 (Lim et al., 2020). 그 결과 6-OHDA에 의해 133.42%까지 증가된 cleaved caspase-3는 CP에 의해 104.01%까지 감소되는 것을 확인하였으며, 이는 SNpc에 분포되어 있는 다수의 신경세포의 apoptosis 현상을 CP가 억제하는 것으로 판단된다(Fig.4).
3.5. CP의 행동장애 개선 효과
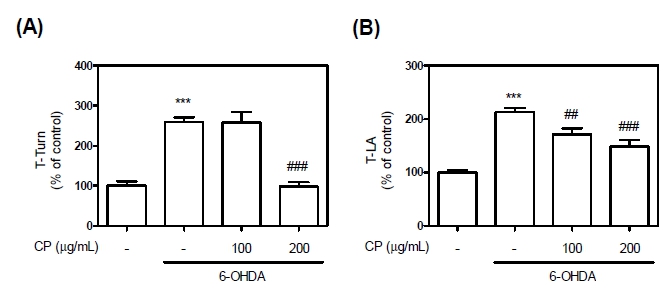
본 연구진은 파킨슨병 행동장애 개선 여부를 확인을 위해 pole test를 실시하였다. Pole test는 일반적으로 근육의 경직증상을 확인할 수 있는 행동실험으로 파킨슨병 동물 모델에서의 행동학적 변화를 평가하는데 사용된다 (Lim et al., 2020). 6-OHDA 처리 시 T-trun 및 T-LA에서 259.39%, 213.01%로 더딤을 보임에 따라 파킨슨병 행동장애가 적절하게 유발되었음을 확인할수 있었으며, CP에 의해 97.82%, 148.86%까지 감소되는 것으로 보아 CP는 파킨슨병 행동장애를 억제하는데 효능을 가졌다고 판단된다(Fig.5).
4. 결 론
현재 파킨슨병은 전세계 약 1,000만명이 앓고 있으나, 아직 정확한 발병 원인을 밝히지 못하였으며, 그에 따른 근본적인 치료법도 없는 질환 중 하나다 (Poewe et al., 2017; Schneider et al., 2017). 최근 밝혀진 바에 따르면, 오염된 물에서 흔히 발견되는 화학물질인 트리클로로에틸렌에 노출되면 파킨슨병 발병위험이 크게 증가한다는 것이 밝혀졌으며, 화학공정에서 부산물로 나오는 프로테아솜 억제물질이라고 불리는 환경독소가 진행성 신경질환인 파킨슨병을 일으킬 수 있다는 연구결과가 보고된 바가 있다 (Uversky et al., 2001; Poewe et al., 2017; Dorsey et al., 2023; Liang et al., 2023). 이처럼 리뷰 이론으로만 존재했던 환경오염에 의한 파킨슨병의 유병율 상관관계는 산업화 현대사회를 살아가는데 생명의 위협을 가하고 있다. 본 연구진은 이를 해결하기 위한 치료 방법을 탐색하고 있으며 (Park, 2022), 최근 한국의 전통의학서인 동의보감에서 선퇴라는 한약재를 선별하였다. 선퇴는 한의학적으로 약성이 싱겁고, 달며, 차갑다 (Lim et al., 2019; Park et al., 2019; Heo, 2007). 그 효능은 산풍열 (散風熱), 선폐 (宣肺), 투진 (透疹), 해경 (解痙)한다.한다고 하여 소아경간 (小兒驚癎), 야체 (夜啼), 파상풍, 목적 (目赤), 예장 (翳障) 등의 적응증에 사용한다고 알려져 있다 (Lim et al., 2019; Park et al., 2019; Heo, 2007). 이전의 우리는 동의보감 현대화 연구를 통해 선퇴가 파킨슨병을 억제할수 있다는 근거를 찾았으며, 이는 Nurr1이라는 도파민계 신경세포의 분화 과정에서 매우 중요한 역할을 하는 유전자의 활성화를 통해 파킨슨 행동장애를 개선한다고 보고한 바가 있다 (Lim et al., 2019). 뿐만 아니라, 신경세포에 항산화물질을 향상시키는데 중요한 역할을 하는 Nrf2의 활성을 증대하여 유의미한 효과를 가질수 있다는 근거 또한 구축한 바가 있다 (Lim et al., 2022). 이에 대한 우리의 연구에서 산업화 단계를 거치는 과정 중 다양한 파킨슨병 실험 모델에 적용하는 것이 매우 중요하며, 본 연구진인 다빈도로 사용되는 파킨슨병 모델인 6-OHDA 신경독성을 활용한 세포, 동물모델을 활용하여 확인 실험을 진행하였다. 그 결과 CP는 ROS와 caspase-3를 억제하여 신경세포의 apoptosis를 효과적으로 억제하였으며, 도파민 함량 유지 및 파킨슨병 행동장애를 유의미하게 억제했음을 확인하였다. 특히 Nurr1 조절에서 산출물로 알려진 TH의 양을 유의미하게 증가시키는 것으로 보아 이전 연구에서의 Nurr1 활성화 특성을 띈 CP의 항파킨슨병 효과로 생각될 수 있다. 우리는 동의보감에 적시되어 있는 선퇴를 경간 (驚癎)에 사용한다는 근거를 기초로 하여 다학계의 자문을 통해 파킨슨병에 치료 가능성을 확보했으며, 이전 연구를 통해 파킨슨병 치료제로써의 가능성을 일부 확인하였다. 이번 연구를 통해 6-OHDA모델을 통해 이를 재입증함으로써 향후 치료 및 예방 약물로 개발에 가능성을 더욱 확신할수 있었으며, 치료제 개발에 있어 매우 중요한 기초자료가 될 것으로 생각된다.
Acknowledgments
본 연구는 한국한의학연구원 ‘지속가능한 한약표준자원 활용기술 개발’ (KSN1822320) 및 ‘선퇴 추출물의 파킨슨병 억제 기술 업그레이드 연구’ (KSN20234313) 사업 지원으로 수행되었다.
References
-
Dorsey, E. R., Zafar, M,, Lettenberger, S. E., Pawlik, M. E., Kinel, D., Frissen, M., Schneider, R. B., Kieburtz, K., Tanner, C. M., Miranda, R. R. D., Goldman, S. M., Bloem, B. R., 2023, Trichloroethylene: An Invisible Cause of Parkinson's Disease?, J. Parkinsons Dis., 13, 203-218.
[https://doi.org/10.3233/JPD-225047]
- Heo, J., 2007, Dongui-Bogam, 1st ed., Jeonghaeng Publishers Co, Seoul, 1698-1705.
-
Liang, Y., Zhong, G., Ren, M., Sun, T., Li, Y., Ye, M., Ma, C., Guo, Y., Liu, C., 2023, The role of Ubiquitin-proteasome system and mitophagy in the pathogenesis of parkinson's disease, Neuromolecular Med., 2023.
[https://doi.org/10.1007/s12017-023-08755-0]
-
Lim, H. S., Kim, J. S., Moon, B. C., Choi, G., Ryu, S. M., Lee, J., Ang, M. J., Jeon, M., Moon, C., Park, G., 2019, Cicadidae periostracum, the Cast-off skin of cicada, Protects Dopaminergic Neurons in a Model of Parkinson's Disease, Oxid. Med. Cell. Longev., 2019, 5797512.
[https://doi.org/10.1155/2019/5797512]
-
Lim, H. S., Moon, B. C., Lee, J., Choi, G., Park, G., 2020, The insect molting hormone 20-hydroxyecdysone protects dopaminergic neurons against MPTP-induced neurotoxicity in a mouse model of Parkinson's disease, Free Radic. Biol. Med., 159, 23-36.
[https://doi.org/10.1016/j.freeradbiomed.2020.07.010]
-
Lim, H. S., Moon, B. C., Park, G., 2022, Nrf2 signaling contributes to the neuroprotective effect of Cicadidae Periostracum against 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine toxicity, Bangladesh J. Pharmacol., 17, 57472.
[https://doi.org/10.3329/bjp.v17i1.57472]
-
Lim, H. S., Yoon, K. N., Chung, J. H., Lee, Y. S., Lee, D. H., Park, G., 2021, Chronic ultraviolet irradiation to the skin dysregulates adrenal medulla and dopamine metabolism In vivo, Antioxidants (Basel)., 10, 920.
[https://doi.org/10.3390/antiox10060920]
-
Park, G., 2022, Oxidative damage in Korean medicine, Antioxidants, 11, 600.
[https://doi.org/10.3390/antiox11030600]
-
Park, G., Kim, Y. U., Kusuma, I. W., 2019, Discovery of novel animal-based medicinal products with therapeutic potential in evidence-based traditional medicine, Evid. Based. Complement. Alternat. Med., 2019, 1626543.
[https://doi.org/10.1155/2019/1626543]
-
Poewe, W., Seppi, K., Tanner, C. M., Halliday, G. M., Brundin, P., Volkmann, J., Schrag, A., Lang, A. E., 2021, Parkinson disease, Nat Rev Dis Primers., 3, 14013.
[https://doi.org/10.1038/nrdp.2017.13]
-
Schneider, R. B., Iourinets, J., Richard, I. H., 2017, Parkinson’s disease psychosis: Presentation, diagnosis and management, Neurodegener Dis Manag., 7, 365–376.
[https://doi.org/10.2217/nmt-2017-0028]
-
Uversky, V. N., Li, J., Fink, A. L., 2001, Metal-triggered structural transformations, aggregation, and fibrillation of human alpha-synuclein. A possible molecular NK between Parkinson's disease and heavy metal exposure, J. Biol. Chem., 276, 44284-44296.
[https://doi.org/10.1074/jbc.M105343200]
Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicine
qp1015@kiom.re.kr
Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicine/University of Science & Technology (UST), Korean Convergence Medicine Major, Campus of Korea Institute of Oriental Medicine
gpark@kiom.re.kr, parkgunhyuk@gmail.com