제주 스코리아의 제올라이트화에 따른 구리와 아연 이온의 흡착 용량 변화
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Scoria from Jeju-island (Jeju scoria) was converted into zeolitic material (Z-SA) via zeolitification using the fusion/hydrothermal method. Jeju scoria could be synthesized into Z-SA to from a surface covered with Na-A zeolite crystals, which was confirmed through an analysis of X-ray diffraction peak patterns and scanning electron microscopy images. Jeju scoria and Z-SA were employed as adsorbents to evaluate the adsorption rate and adsorption capacities for Cu2+ and Zn2+ ions. The adsorption rates and isothermal adsorption capacities could be well fitted by the pseudo-quadratic adsorption kinetics and Langmuir adsorption isotherm, respectively. The maximum adsorption capacities (qm) of Z-SA for Cu2+ and Zn2+ ions were found to be 163.36 mg/g and 120.51 mg/g, respectively, using the Langmuir adsorption isotherm. When Z-SA is synthesized from Jeju scoria via zeolitification using the fusion/hydrothermal method, Z-SA exhibits an adsorption capacity that is more than approximately 100 times the value exhibited by Jeju scoria. As a result, the synthesized Z-SA was regarded as an effective, economic adsorbent.
Keywords:
Scoria, Zeolitic material, Adsorption, Zeolitification, Copper, Zinc1. 서 론
제주도 기생화산 지역에 널리 산재하는 스코리아는 화산폭발로부터 분출된 화산암, 화산모래, 화산재 등이 혼합되어 있는 다양한 무기물질로서 가볍고, 쉽게 파괴되지 않을 정도의 강도를 지니고 있다(Yoon, 1995). 또한, 다른 천연광물에 비해 철분 함량이 높아 짙은 회색에서 검은 색을 띄고, 미세 다공성 구조로 되어 있어 미생물 및 다른 물질이 부착할 수 있는 높은 비표면적을 가지고 있으며(Sharafi et al., 2019), 가격도 저렴하여 일반적인 흡착제로의 사용가능성이 충분하다.
화산지역에 산재하는 스코리아와 천연광물인 경석을 이용한 중금속(Moraci et al., 2010), 페놀(Sharafi et al., 2019), SO2 가스(Ozturk and Yildirim, 2008)을 제거하는 연구가 일부 이루어져 왔다. 스코리아와 천연광물 유래의 흡착제는 폐수 중의 중금속 물질의 제거에 적용되는 천연 제올라이트와 같은 흡착제와 비교해서 중금속 흡착성능이 매우 낮기 때문에 흡착제로 스코리아를 적용하기에 한계성이 있다(Kam et al., 1999). 하지만, 스코리아는 성분 내 실리카와 알루미나가 60% 이상 함유되어 있기 때문에 화학적 처리에 의해 제올라이트화를 통해 유용한 흡착제로 전환이 가능하다(Yoon, 1995).
스코리아의 제올라이트화는 일부 연구자들(Yoshida and Inoue, 1986; Jeon et al., 2004; Novembre et al., 2004; Lee et al., 2018)에 의해 전 세계 화산지대에 널리 퍼져 있는 스코리아를 이용하여 다양한 제올라이트의 합성 및 실험적 절차를 확립해 왔다. Yoshida and Inoue(1986)는 일본에 산재하는 화산유리를 수열합성법을 이용하여 결정화시간 24–72 h와 2 M의 NaOH 농도에서 faujasite로 제올라이트화가 가능하였다고 보고하였다. Jeon et al.(2004)은 제주 스코리아를 이용하여 알카리 처리 및 수열합성에 의해 Na-P1 제올라이트를 합성하였다. Novembre et al.(2004)은 알칼리성 SiO2와 Al2O3를 사용하여 3M의 NaOH 농도에서 수열합성법에 의해 자연적으로 제올라이트화된 Italian Crotone Basin 화산암으로부터 결정화시간 5–18 h에서 Na-X 제올라이트를 제조할 수 있었다.
제올라이트 물질을 이용한 금속이온 제거의 연구는 clinoptilolite(Sprynskyy et al., 2006), 제올라이트-시멘트 비드(Ok et al., 2007), 제주 스코리아를 이용한 합성 제올라이트(Kim et al., 2020) 및 Na-P1 제올라이트(Kam et al., 2011) 등을 이용한 사례가 있었다. Sprynskyy et al.(2006)은 천연 제올라이트(clinopti-lolite)를 흡착제로 이용하여 Cu2+ 이온 흡착 연구에서 흡착량 9.1 mg/g라고 보고하였다. 또한, Ok et al.(2007)은 제올라이트와 cement와 혼합하여 제조한 비드의 Cu2+ 이온 흡착량이 23.25 mg/g이라고 하였다. Kam et al.(2011)는 제주 스코리아로부터 제조된 Na-P1 제올라이트의 Cu2+ 이온의 흡착량은 32.9 mg/g이라고 하였다. Jo et al.(2021)과 Kim et al. (2020)은 제주 스코리아로부터 합성한 제올라이트에 의한 Co2+와 Zn2+ 이온 흡착량이 각각 68.7 mg/g과 112.1 mg/g이라고 하였다.
본 연구에서는 제주 화산지역에 산재하는 스코리아를 이용하여 Lee et al.(2020)에서 제시한 용융/수열합성법에 의해 제올라이트화 하였고, 합성된 제올라이트 물질(Z-SA)을 X-선 회절분석기와 주사전자현미경으로부터 결정학적 및 광학적 특성을 확인하였다. 또한, 제주 스코리아와 합성된 Z-SA를 이용하여 Cu2+와 Zn2+ 이온의 흡착속도와 등온흡착량을 비교하여 평가하였다.
2. 재료 및 방법
2.1. 실험 재료
본 연구에 사용된 제주 스코리아는 ㈜송이산업에서 분말형태의 제품을 구입하였으며, 제주 스코리아로부터 제올라이트의 합성은 200 mL 부피의 교반과 온도가 제어되는 스텐레스 재질의 합성반응기를 사용하였으며, 합성 조건은 Lee et al.(2018)이 제시한 결과로부터 NaOH/scoria 비를 1.2로 조절 후 550℃에서 1시간동안 소성시키고, 소성된 시료를 상온으로 식힌 후 NaAlO2를 일정량 첨가하여 SiO2/Al2O3 몰비를 2.5로 맞추었다. 소성된 시료와 NaAlO2를 혼합한 시료를 수용액에서 교반하면서 숙성(30℃, 5시간) 및 결정화(90℃, 5시간) 과정을 거쳐 제올라이트를 합성하였다. 합성된 시료는 탈이온수로 수차례 세척하고 건조한 후 분쇄하고, 200 mesh의 채로서 입도선별하여 실험에 사용하였다. Cu2+와 Zn2+의 용액은 각각 특급시약 Zn (NO3)2·6H2O, Cu(NO3)2ㆍ3H2O(Aldrich, EP)을 구입하여 사용하였다. 시약은 탈이온수로 1,000 mg/L 모액을 조제하고, 이 모액을 탈이온수로 10~200 mg/L으로 희석하여 사용하였으며, 이 때 0.1 N-HNO3/ NaOH로 용액의 pH를 5로 조정하였다.
2.2. 흡착제의 특성 분석
제주 스코리아와 합성 제올라이트(Z-SA)는 X-선 회절분석기(XRD, D8 Advance, Bruker AXS, Germany)와 주사전자현미경(SEM, Hitachi S-4200, Japan)을 이용하여 결정화와 표면특성을 분석하였다.
2.3. Cu2+와 Zn2+의 흡착 실험
흡착제 종류에 따른 Cu2+와 Zn2+의 흡착 특성은 회분식으로 실험하였다. 즉, 500 mL의 삼각플라스크에 pH 5로 조정된 Cu2+와 Zn2+ 표준용액(10∼200 mg/L) 200 mL에 일정량의 흡착제(제주 스코리아 5 g, Z-SA 0.05 g)를 넣고 수평진탕기(Sci Labshake, SSO-2D, Korea)로 200 rpm 속도로 교반하였다. 흡착 실험 중 일정 시간마다 2 mL의 시료를 채취하여 시간에 따른 Cu2+와 Zn2+의 농도변화를 측정하여 평형에 도달하면 실험을 종료하였다. 이 때 반응온도는 항온조를 사용하여 25℃의 일정하게 유지하였다.
채취한 시료는 원심분리기(Eppendorf, Centrifuge 5415c, Germany)로 10,000 rpm에서 5 min 동안 원심분리한 후 상등액을 취하여 유도결합플라즈마 원자방출분광기(ICP : Agilent Technologies, 5100 ICP- OES)로 분석하였다.
흡착제에 흡착된 Cu2+와 Zn2+의 흡착량(qt와 qe)은 각각 식(1)과 식(2)를 이용하여 계산하였다.
| (1) |
| (2) |
여기서 qt과 qe는 각각 임의시간 t와 평형시간에서 흡착제의 흡착량(mg/g)이고, Co는 Cu2+와 Zn2+ 용액의 초기 농도(mg/L), Ct와 Ce는 각각 임의시간 t와 평형시간에서 Cu2+와 Zn2+ 용액의 농도(mg/L)이고, V는 용액의 부피(L)이고, m은 흡착제의 양(g)이다.
3. 결과 및 고찰
3.1. 흡착제의 물리화학적 특성
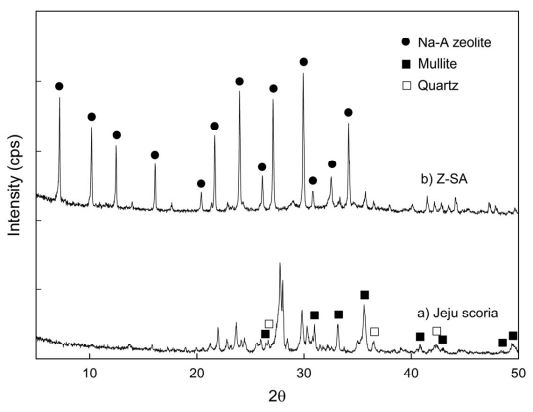
이전 연구(Lee et al., 2018, 2020)에서 적용된 흡착제인 제주 스코리아와 합성 제올라이트(Z-SA)는 SiO2와 Al2O3의 함량이 각각 46.8%와 18.8% 및 35.6%와 31.9%이었다. 제주 스코리아로부터 SiO2/Al2O3 몰비와 NaOH/scoria 비를 각각 2.5와 1.2로 조절한 후 숙성과 결정화 과정을 거쳐 Z-SA를 합성하였다. Fig. 1은 흡착제로 사용된 제주 스코리아와 합성 제올라이트(Z-SA)의 XRD 피크를 나타낸 것이다. Fig. 1. (a) 제주 스코리아는 SiO2와 Al2O3의 결정구조를 가지는 mullite(3Al2O3⋅2SiO2)와 quartz(SiO2)의 XRD 피크가 주로 확인되었다. Fig. 1. (b) Z-SA는 7.18 ∼ 34.18의 2θ 구간에서 Treacy and Higgins(2001)가 제시한 Na-A형 제올라이트(Na12Al12Si12O4827.4H2O)의 XRD 특성 피크와 일치하므로 Na-A 제올라이트로 결정화되었음을 확인할 수 있었다.
Fig. 2는 제주 스코리아와 Z-SA의 SEM 이미지(×10,000)를 비교하여 나타낸 것으로, Fig. 2 (a) 제주 스코리아는 mullite와 quartz가 주성분인 무정형의 결정구조를 나타내었다. 하지만, Fig. 2 (b) Z-SA는 용융/수열합성에 의한 제올라이트화 과정에서 스코리아의 SiO2와 Al2O3 성분들이 Na-A형 제올라이트 결정으로 형성되어 약 1.0~2.0 ㎛ 크기의 정육면체 결정이 입자의 표면을 덮고 있다는 것을 관찰할 수 있었다. 이 결과는 Tanaka and Fujii(2009)와 Lee et al.(2014)의 비산재로부터 합성한 Na-A 제올라이트와 유사한 결정구조이며, 결정화 진행과정에서 cenosphere 표면상에 결정화된 Na-A 제올라이트가 덮인다는 결과와 유사하였다.
3.2. 접촉시간의 영향
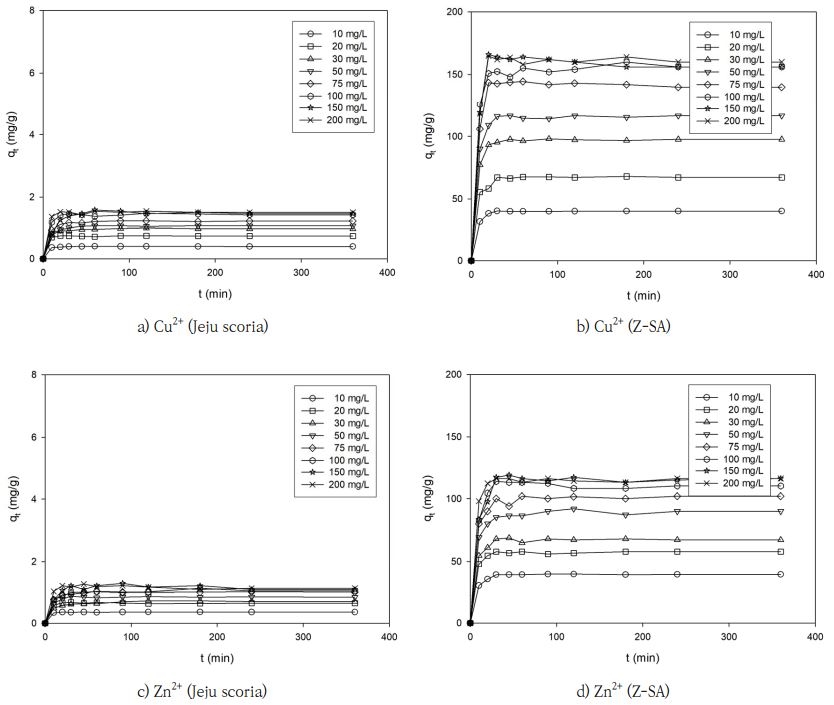
제주 스코리아와 Z-SA를 이용하여 접촉시간에 따른 Cu2+와 Zn2+ 흡착량의 변화를 Fig. 3에 나타내었다. Fig. 3에서 보듯이 제주 스코리아 및 Z-SA의 흡착제는 대체적으로 60분 이내로 비교적 빠르게 평형에 도달함을 알 수 있었는데, 이러한 결과는 pH 4 용액에서 석탄재로 합성한 4A 제올라이트를 이용한 수 중 Cu2+와 Zn2+의 흡착에서 흡착평형이 60분 이내에 도달한다는 결과(Hui et al., 2005) 및 제주 스코리아에 의한 Cu2+이온의 흡착(Kam et al., 2002b; Lee et al., 2002) 및 이로부터 합성한 다양한 형태의 제올라이트(analcime, cancrinite, Na-P1, nepheline hydrate, sodalite)에 의한 Cu2+ 이온의 흡착(Hyun, 1999; Kam et al., 2002a)에서 흡착 평형은 대부분 60 min 이내에 도달하였다는 결과와 일치하였다. 스코리아를 이용한 수중에 존재하는 미량의 Pb2+, Cu2+, Zn2+, Cd2+, and As3+ 이온의 흡착 실험에서 Cu2+와 Zn2+ 이온이 각각 약 12 hr에서 평형에 도달하였다는 결과(Kwon et al., 2010) 및 비산재로부터 FAU형 제올라이트를 제조하여 용액 중의 Cd2+, Co2+, Cu2+, Pb2+, 그리고 Zn2+ 이온을 흡착한 결과에서 Cu2+ 이온의 경우, 약 60 min 정도에 흡착평형에 도달하지만, Zn2+ 이온은 약 120 min 정도가 소요된다고 보고한 결과(Joseph et al, 2020)와 차이를 보였는데, 이러한 결과는 흡착제의 특성 및 실험 반응조건의 차이에 기인하는 것으로 판단된다.
3.3. 흡착 속도
제주 스코리아와 Z-SA의 접촉시간에 따른 Cu2+와 Zn2+ 흡착량을 이용하여 식 (3)의 유사 1차 속도식(Lagergren, 1898)과 식 (4)의 유사 2차 속도식(Ho and MaKay, 1998)으로부터 흡착속도를 산정하였다.
| (3) |
| (4) |
여기서, k1과 k2는 각각 유사 1차 속도상수(1/min)와 유사 2차 속도상수(g/mg/min)이다.
Table 1과 Fig. 4의 Cu2+와 Zn2+의 흡착속도에서 나타낸 바와 같이 제주 스코리아와 Z-SA를 이용한 Cu2+와 Zn2+ 이온의 흡착속도는 실험값(qe,exp)과 예측값(qe,cal)을 비교하면, 유사 1차 속도식이 Cu2+와 Zn2+ 이온의 흡착속도 예측에 있어 실험값과 일치하는 경우도 있었지만 초기의 흡착속도를 예측하기에는 한계가 있었다. 그러나 유사 2차 속도식은 Cu2+와 Zn2+ 이온에서 모두 qe,cal이 qe,exp에 거의 근접하여 정확한 예측이 가능하였다. 즉, Cu2+ 이온의 경우, 제주 스코리아와 Z-SA의 R2 값은 각각 0.4835∼0.9957과 0.3093∼1.0000으로서 유사 1차 속도식에 비해 R2의 값이 각각 0.9988∼0.9999와 0.9985∼1.0000인 유사 2차 속도식이 더 높은 결과를 나타내었다. Zn2+ 이온의 경우, 제주 스코리아와 Z-SA의 R2 값이 각각 0.3942∼0.9642와 0.3615∼0.7868인 유사 1차 속도식에 비해 R2의 값이 각각 0.9962∼0.9999와 0.9996∼0.9999인 유사 2차 속도식이 더 높아 Cu2+ 이온과 거의 유사한 결과를 나타내었다. 이 결과로부터 제주 스코리아와 Z-SA에 의한 Cu2+와 Zn2+ 이온의 흡착속도는 유사 1차 속도식 보다는 유사 2차 속도식으로 더 잘 예측할 수 있었다. 이러한 결과는 제주 화산석을 이용한 Cu2+ 이온 제거 연구(Kwon et al., 2010), 석탄 비산재로부터 합성된 제올라이트 물질을 이용한 Sr2+과 Cs+ 이온을 제거 연구(Lee et al., 2014) 및 석탄 비산재 유래 Na-A 제올라이트를 이용한 혼합된 Co2+, Cr3+, Cu2+, Zn2+ 및 Ni2+ 이온의 제거(Hui et al., 2005)에서 흡착속도는 유사 1차 속도식 보다는 유사 2차 속도식에 부합하다는 결과와 일치하였다.
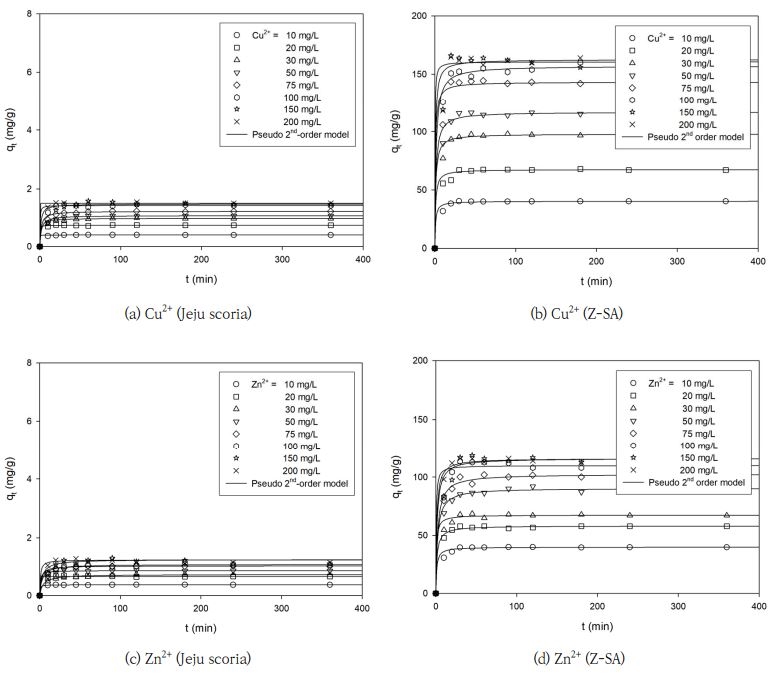
Adsorption kinetics for the adsorption of Cu2+ and Zn2+ by adsorbents (a) and (c) for Jeju scoria, (b) and (d) for Z-SA.
제주 스코리아와 Z-SA을 이용한 Cu2+ 이온의 qe는 각각 0.396∼1.486 mg/g와 39.659∼160.716 mg/g이었으며, Zn2+ 이온의 qe는 각각 0.361∼1.214 mg/g와 39.169∼116.018 mg/g을 나타내었다. 이 결과로부터 Cu2+와 Zn2+ 이온의 qe는 제주 스코리아에 비해 제주 스코리아를 제올라이트화한 Z-SA가 약 100배 정도 증가하는 경향을 보였다.
3.4. 흡착등온식
본 연구에 사용된 제주 스코리아와 Z-SA에 의한 Cu2+와 Zn2+ 의 등온흡착실험 결과를 Langmuir와 Freundlich 흡착 등온식에 적용하여 등온흡착량을 산정하였다. 단분자층 흡착을 가정한 Langmuir 등온 흡착식(Langmuir, 1918)과 흡착제와 흡착질 분자 사이의 다분자층 흡착을 가정한 Freundlich 등온 흡착식(Freundlich, 1906)은 각각 식 (5)과 식 (6)과 같이 나타낼 수 있다.
| (5) |
| (6) |
여기서, qm과 kL은 각각 최대 흡착량(mg/g)와 Langmuir 상수(L/mg)이고, KF는 Freundlich 상수로 흡착제의 흡착능에 대한 척도를 의미한다. 1/n은 흡착강도를 나타내는 상수이다.
제주 스코리아와 Z-SA을 이용하여 Cu2+와 Zn2+의 등온 흡착실험 결과를 Fig. 5에 나타내었다. 이 결과를 식 (5)과 식 (6)에 적용하여 얻은 파라미터 값들을 Table 2에 나타내었다. Table 2에서 나타낸 바와 같이 제주 스코리아와 Z-SA에 의한 Cu2+와 Zn2+ 이온의 흡착은 Langmuir 등온식의 경우, 각각 R2 값은 0.9957~0.9982과 0.9973~0.9974의 범위를 나타내었으며, Freundlich 등온식의 경우, 제주 스코리아와 Z-SA에 의한 R2 값은 각각 0.9663~0.9718과 0.9371~0.9604로서 Langmuir 등온식에 비해 상대적으로 낮았다. 이 결과로부터 각 흡착제에 의한 Cu2+와 Zn2+ 이온의 등온흡착량은 Freundlich 등온식에 비해 Langmuir 등온식에 의해 더 잘 예측되는 결과를 나타내었다. Qiu and Zheng(2009)의 결과에서 비산재로 합성한 cancrinite형 제올라이트의 중금속 이온(Pb2+, Cu2+, Ni2+, Co2+, Zn2+) 흡착은 제올라이트의 결정구조 내 SiO-의 흡착점 상에서 표면반응 및 이온교환에 의해 진행되기 때문에 등온흡착결과는 단분자층 흡착을 가정한 Langmuir 등온식이 다분자층 흡착을 가정한 Freundlich 등온식에 비해 더 정확한 해석이 가능하다고 하였다. Hui et al.(2005)은 비산재로부터 합성한 제올라이트 4A 상에 혼합 중금속 이온(Co2+, Cr3+, Cu2+, Ni2+, Zn2+) 용액의 흡착시킨 결과에서도 Langmuir 등온식에 잘 부합된다고 보고와 일치하며, 각 이온에 대한 흡착성능은 용액 중에 수화된 금속이온반경이 Na-A형 제올라이트의 공극 4.2Å에 근접하는 Cu2+ (4.19Å) > Co2+ (4.23Å) > Zn2+ (4.30Å) 이온의 순으로 진행되며, Na-A 제올라이트 공극의 크기 이상의 수화반경을 가지는 금속이은은 흡착시 전달저항이 작용하여 상대적으로 흡착량이 감소한다고 하였다. Cu2+ 이온의 Langmuir 등온식에 의한 최대흡착량(qm)은 Z-SA에서 163.3 mg/g와 제주 스코리아에서 1.5 mg/g으로 나타났다. 또한, Zn2+ 이온의 qm는 Z-SA에서 120.5 mg/g와 제주 스코리아에서 1.1 mg/g이었다. 특히, 제주 스코리아를 용융/수열합성에 의해 Z-SA로 합성할 경우, Cu2+와 Zn2+ 이온의 qm에서 모두 약 100배이상 증가하여 금속이온 제거을 위한 우수한 성능의 흡착제임을 확인할 수 있었다.
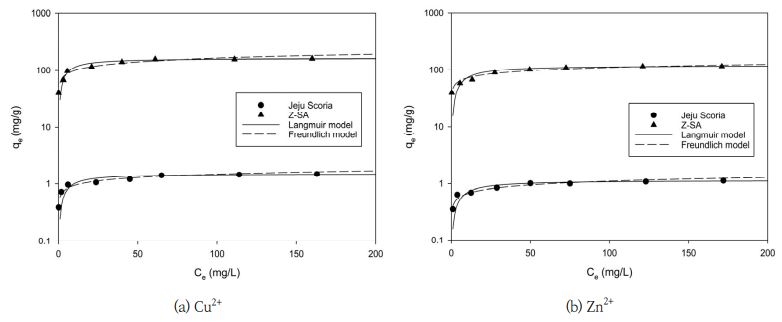
Adsorption isotherms for the adsorption of (a) Cu2+ and (b) Zn2+ by adsorbents (Jeju scoria and Z-SA)
4. 결 론
본 연구에서는 제주 화산지역에서 산재하는 제주 스코리아를 이용하여 용융/수열합성법에 의해 제올라이트화하고, 이를 흡착제로 사용하여 Cu2+와 Zn2+ 이온의 흡착속도와 흡착용량을 평가하였다.
제주 스코리아는 용융/수열합성법을 이용하여 Na-A 제올라이트로 제올라이트화 할 수 있었으며, XRD 피크와 SEM의 분석을 통해 스코리아 입자 표면상에 Na-A 제올라이트가 결정화되어 표면을 덮는다는 것을 확인할 수 있었다.
제주 스코리아와 Z-SA에 의한 Cu2+와 Zn2+ 이온의 흡착속도와 등온흡착량은 각각 유사 2차 흡착속도식과 Langmuir 흡착등온식에 의해 잘 모사할 수 있었다. Langmuir 흡착등온식에 의한 Cu2+의 최대 흡착량(qm)은 제주 스코리아에서 1.50 mg/g와 Z-SA에서 163.36 mg/g이었으며, Zn2+의 qm은 제주 스코리아에서 1.14 mg/g와 Z-SA에서 120.51 mg/g이었다.
제주 스코리아를 용융/수열합성법에 의해 제올라이트화(Z-SA)하게 되면, 스코리아 표면이 이온교환성능을 가지는 Na-A 제올라이트 결정으로 덮이게 되어 Cu2+와 Zn2+ 이온의 흡착용량이 약 100배 정도 증가되는 결과를 보여 흡착제로서의 경제적 활용가치를 높일 수 있었다.
REFERENCES
-
Freundlich, H. M. F., 1906, Over the adsorption in solution, J. Phys. Chem., 57(1), 385-470.
[https://doi.org/10.1515/zpch-1907-5723]

-
Ho, Y. S., McKay, G., 1998, The kinetics of sorption of basic dyes from aqueous solution by sphagnum moss peat, Can. J. Chem. Eng., 76(4), 822-827.
[https://doi.org/10.1002/cjce.5450760419]

- Hyun, S. S., 1999, Studies on the removal of heavy metal ions in wastewater using the zeolites synthesized from Cheju scoria, MS Thesis, Cheju National University, Cheju, 1-70.
-
Hui, K. S., Chao, C. Y. H., Kot, S. C., 2005, Removal of mixed heavy metal ions in wastewater by zeolite 4A and residual products recycled coal fly ash, J. Hazard. Mater., B127, 89-101.
[https://doi.org/10.1016/j.jhazmat.2005.06.027]

- Jeon, B. E., Ahn, B. J., Chang, W. H., Kam, S. K., Lee, M. G., 2004, Zeolitic conversion of cheju scoria, J. Ind. Eng. Chem., 10(4), 618-622.
- Jo, E., Lee, C. H., Kim, M. I., 2021, Removal of cobalt ion in aqueous solution using zeolitic materials synthesized from Jeju volcanic rocks, J. Environ. Sci. Int., 30(9), 719-726.
-
Joseph, I. V., Tosheva, L., Doyle, A. M., 2020, Simultaneous removal of Cd(II), Co(II), Cu(II), Pb(II), and Zn(II) ions from aqueous solutions via adsorption on FAU-type zeolites prepared from coal fly ash, J. Environ. Chem. Eng., 8, 103895.
[https://doi.org/10.1016/j.jece.2020.103895]

- Kam, S. K., Kim, D. S., Lee, M. G., 1999, Comparions of removal performances of divalent heavy metals by natural and pretreated zeolites, J. Environ. Sci. Int., 8, 399-409.
-
Kam, S. K., Hong, J. Y., Hyun, S. S., Ahn, B. J., Lee, M. G., 2002a, Removal of copper ion by Na-P1 synthesized from Jeju scoria, J. Environ. Sci., 11(1), 75-83.
[https://doi.org/10.5322/JES.2002.11.1.075]

- Kam, S. K., Hyun, S. S., Lee, M. G., 2002b, Adsorption characteristics of copper and lead ions by Jeju Scoria, J. Korean Soc. Environ. Eng, 24(1), 57-69.
-
Kam, S. K., Hyun, S. S., Lee, M. G., 2011, Adsorption of lead ion by zeolite synthesized from Jeju Scoria, J. Environ. Sci. Int., 20, 1437-1445.
[https://doi.org/10.5322/JES.2011.20.11.1437]

- Kim, J. T., Lee, C. H., Kam, S. K., 2020, Adsorption characteristics of Ni2+, Zn2+ and Cr3+ by zeolite synthesized from Jeju scoria, J. Environ. Sci. Int., 29(7), 739-748.
-
Kwon, J. S., Yun, S. T., Lee, J. H., Kim, S. O, Jo, H. Y., 2010, Removal of divalent heavy metals (Cd, Cu, Pb, and Zn) and arsenic(III) from aqueous solutions using scoria: Kinetics and equilibria of sorption, J. Hazard. Mater., 174, 307-313.
[https://doi.org/10.1016/j.jhazmat.2009.09.052]

- Lagergren, S., 1898, About the theory of so-called adsorption of soluble substances, Kunglia Svenska Vetenskapsa-kademiens Handlingar, 24(4), 1-39.
-
Langmuir, I., 1918, The adsorption of gases on plane surface of glass, mica and platinum, J. Am. Chem. Soc., 40(9), 1361-1403.
[https://doi.org/10.1021/ja02242a004]

- Lee, C. H., Hyun, S. S., Kam, S. K., 2020, Adsorption characteristics of ammonia-nitrogen by zeolitic materials synthesized from Jeju scoria, 29(11), 1089-1098.
-
Lee, C. H., Park, J. M., Lee, M. G., 2014, Adsorption characteristic of Sr(II) and Cs(I) ions by zeolite synthesized from coal fly ash, J. Environ. Sci. Int., 23(12), 1987-1998.
[https://doi.org/10.5322/JESI.2014.23.12.1987]

- Lee, M. G., Lim, J. H., Hyun, S. S., Kam, S. K., 2002, Adsorption characteristics of copper Ion by Cheju Scoria, HWAHAK KONGHAK, 40(2), 252-258.
-
Lee, M. G., Park, J. W., Kam, S. K., Lee, C. H., 2018, Synthesis of Na-A zeolite from Jeju Island scoria using fusion/hydrothermal method, Chemosphere, 207, 203-208.
[https://doi.org/10.1016/j.chemosphere.2018.05.080]

-
Moraci, N., Calabro, P. S., 2010, Heavy metals removal and hydraulic performance in zero-valent ironpumicepermeable reactive barriers, J. Env. Man., 91, 2336-2341.
[https://doi.org/10.1016/j.jenvman.2010.06.019]

-
Novembre, D., Di Sabatino, B., Gimeno, D., Garcia-Valles, M., Martínez-Manent, S., 2004, Synthesis of Na-X zeolites from tripolaceous deposits (Crotone, Italy) and volcanic zeolitised rocks (Vico volcano, Italy), Microporous Mesoporous Mater., 75, 1-11.
[https://doi.org/10.1016/j.micromeso.2004.06.022]

-
Ok, Y. S., Yang, J. E., Zhang, Y. S., Kim, S. J., Chung, D. Y. 2007, Heavy metal adsorption by a formulated zeolite-Portland cement mixture, J. Hazard. Mater. 147, 91-96.
[https://doi.org/10.1016/j.jhazmat.2006.12.046]

-
Ozturk, B., Yildirim, Y., 2008, Investigation of sorption capacity of pumice for SO2 capture, Proc. Saf. Env. Prot., 86, 31-36.
[https://doi.org/10.1016/j.psep.2007.10.010]

-
Qui, W., Zheng, Y., 2009, Removal of lead, copper, nickel, cobalt, and zinc from water by a cancrinite-type zeolite synthesized from fly ash, Chem. Eng. J., 145, 483-488.
[https://doi.org/10.1016/j.cej.2008.05.001]

-
Sharafi, K., Pirsaheb, M., Gupta, V. K., Agarwal, S., Moradi, M., Vasseghian, Y., Dragoli, E. N., 2019, Phenol adsorption on scoria stone as adsorbent - Application of response surface method and artificial neural networks, J. Mol. Liq., 274, 699-714.
[https://doi.org/10.1016/j.molliq.2018.11.006]

-
Sprynskyy, M., Boguslaw, B., Artur, T., Jacek, N., 2006, Study of the selection mechanism of heavy metal adsorption on clinoptilolite, J. Col. Inter. Sci., 304, 21-28.
[https://doi.org/10.1016/j.jcis.2006.07.068]

-
Tanaka, H., Fujii, A., 2009, Effect of stirring on the dissolution of coal fly ash and synthesis of pure form Na-A and -X zeolites by two step process, Adv. Powd. Tech., 20(5), 473-479.
[https://doi.org/10.1016/j.apt.2009.05.004]

- Treacy, M. M. J., Higgins, J. B., 2001, Collection of simulated XRD powder patterns for zeolites, Elsevier, Amsterdam.
- Yoon, J. S., 1995, A study on parasitic cones of the northern parts of Jeju island, Korea, Bull. Mar. Res. Inst., Jeju Nat’l Univ., 19, 25-38.
-
Yoshida, A., Inoue, K., 1986, Formation of faujasite-type zeolite from ground Shirasu volcanic glass. Zeolites 6, 467-473.
[https://doi.org/10.1016/0144-2449(86)90031-X]

Department of Environmental Administration, Catholic University of Pusanchlee@cup.ac.kr
Department of Environmental Engineering, Jeju National Universitysakyukam@jejunu.ac.kr
Department of Environmental Engineering, Jeju National Universityhuchulgo@jejunu.ac.kr