고랭지 여름배추(Brassica rapa subsp. pekinensis)재배에서 8년간 콩(Glycine max)과의 돌려짓기 재배가 토양 환경에 미치는 영향
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, we evaluated productivity, soil physiochemical properties, and soil microbial characteristics in Kimchi cabbage(Brassica rapa subsp. pekinensis) cultivation within a highland environment during summer. Specifically, we examined the effect of different cropping systems, namely monoculture and rotation with soybean, over an 8-year cropping period. The results of our investigation revealed that significant differences were absent in terms of yield and soil physiochemical properties between the two cropping systems. However, microbial characteristics exhibited distinctive patterns. Bacterial diversity was significantly higher in the rotation system that in the monoculture, whereas fungal diversity demonstrated a preference for rotation although the result was not significant. Our findings identified the presence of Bradyrhizobium stylosanthis, a nitrogen-fixation symbiont, as an indicator ASV (amplicon sequence variant) in the rotation system, where it displayed significantly higher abundances. These observations suggest a potential positive effect of the rotation system on nitrogen fixation. Notably, throughout the cultivation period, both cropping systems did not exhibit critical disease incidences. However, Fusarium oxysporum, a well-known pathogen responsible for inducing fusarium wilt disease in Kimchi cabbage, was detected with significantly higher abundance in the monoculture system. This finding raises concerns about the potential risk associated with Kimchi cabbage cultivation in a long-term monoculture system.
Keywords:
Highland kimchi cabbage, Crop rotation, Microbiota1. 서 론
우리나라에서 배추(Brassica rapa subsp. pekinensis)는 김치의 주요 재료로 생육적온이 약 22°C인데 평지에서는 여름철에 기온이 높아 재배가 어렵기 때문에 여름철에는 기온이 낮은 고랭지를 중심으로 재배가 이루어지고 있다(HARI, 2000). 고랭지 배추는 70년대 후반부터 재배가 시작되어 90년대 중반 이후부터는 이어짓기로 인해 무사마귀병, 뿌리혹병 등 토양전염병이 발생하였고 그 피해가 증가하여 생산에 어려움을 겪고 있다(Jung et al., 2007). 또한, 최근 기후 온난화로 인한 온도의 상승과 이상 기후로 인하여 발생하는 태풍, 폭염 등의 돌발 기상이 더해져 2010년 이후 작황은 더욱 불안정하게 되었고, 배추의 수급불안은 예상치 못한 가격 변동으로 이어지게 된다(RDA, 2021).
전국 고랭지 재배 면적의 79.3%를 차지하는 강원도 고랭지 지역은 전체 밭의 47.7%가 경사도 15% 이상에 위치하고 있는데(MAFRA, 2006), 경사밭에서 배추를 오랜 기간 이어짓기하면 토양 전염성 병해가 증가할 뿐 아니라 토양유실, 양분 불균형 등으로 농업생산기반이 약화되기 때문에 배추를 안정적으로 재배하기 위해 작부 체계의 개발 및 대체 작목 제시를 위한 연구가 여러 연구자들을 통해 수행되고 있으며, 배추 재배 시 돌려짓기를 하면 토양 이화학성의 개선, 토양 전염성 병의 발병 감소, 그리고 배추의 생산량이 증가하였다는 보고가 있었다(Kim et al., 2000; Chen et al., 2018; Bak and Lee, 2021).
미생물을 이용하여 작물의 생산성을 증진시키거나 특정 병원균을 억제하기 위한 연구는 이전부터 수행되어 왔으나 최근 기술의 발달과 불안정한 환경 하에서 지속 가능한 농업을 수행하기 위한 노력으로 토양 미생물 군집(microbiota)에 대한 연구가 다양한 작물을 대상으로 활발히 수행되고 있다(Bano et al., 2021). 토양 내 미생물군집을 잘 이용한다면 양분 이용도와 병원균의 침입에 대한 길항력을 증진시켜주는 등 식물체의 생육에 직·간접적인 영향을 줌으로써 보다 안정적으로 작물을 재배할 수 있도록 보조해줄 수 있다. 토양 내 미생물 군집은 크게는 기후, 토성, 토양 환경 등의 영향을 받으며, 농경지에서는 작물의 종류, 재배 관리 형태 그리고 품종 등도 미생물 군집에 영향을 준다(Santos and Olivares, 2021). 그렇기 때문에 많은 연구자들은 작물이 받는 다양한 스트레스로부터 작물을 안정적으로 재배하기 위해 다양한 환경에서 연구를 수행 중에 있다. 작물 생육에 부적합한 수분 혹은 온도 조건, 염이나 중금속 함량이 높은 토양 환경 등의 비생물적 스트레스(Tyagi et al., 2022)와, 해충, 병원균, 선충 등 생물적 스트레스(Benitez et al., 2017; Li et al., 2021)를 작물이 받았을 때 유용 미생물을 이용해 작물의 생육을 촉진시켰다는 연구결과가 계속해서 보고되고 있다.
작부체계가 미생물군집에 미치는 영향과 관련하여 수행된 선행연구에서도 지속적으로 돌려짓기를 하면 이어짓기와 비교하여 작물 생육에 유용한 미생물 군들이 작물의 근권 토양에 공생하게 되어 작물의 생육을 촉진할 수 있다고 밀, 벼, 옥수수, 유채 등에서 보고되었다(Gan et al., 2015; Venter et al., 2016; Town et al., 2022; Town et al., 2023). 배추 작부체계에 따른 미생물군집 연구도 수행되었는데, 이어짓기를 하였을 때와 비교하여 돌려짓기를 하였을 때 미생물 다양성 및 생산성이 증가하였고, 토양 전염 병해인 뿌리혹병의 발병이 감소하였다는 보고가 있었다(Bak et al., 2021; Zhang et al., 2022). 그러나 화분이 아닌 실제 농경지에서 배추 작부체계에 따른 세균과 곰팡이 군집에 대한 연구는 아주 미비한 실정이다.
본 연구에서는 고랭지 여름배추 재배지에서 8년간 배추를 이어짓기 하였을 때와 콩과 돌려짓기 하였을 때의 토양 이화학성 및 미생물군집의 변화를 종합적으로 비교·분석하여 재배 안정성과 관련하여 장기간 배추를 재배하였을 때 배추 작부체계에 따라 발생할 수 있는 요인들을 평가하고 그들에 대한 이해도를 높임으로써 고랭지 배추의 안정 생산에 기여하고자 하였다.
2. 재료 및 방법
2.1. 포장 시험 개요
본 시험은 국립식량과학원 고령지농업연구소(강원도 평창군 대관령면, 해발 700 m)에 위치한 시험포장(37°41’01”N 128°43’38”E)에서 2015년도부터 조성하여 수행하였다. 무상기간이 짧은 대관령은 작물의 재배가 주로 5월부터 10월에 이루어져 1년에 한번씩 작물을 재배하는데, 본 시험에서는 콩과 배추 모두 약 3주간 온실의 상토(쑥쑥이, 상토2호, 농우바이오)에서 육묘를 하여 포장에 정식하였으며, 콩은 1주 2본으로 육묘를 수행하였다. 배추의 재배는 6월 초중순에 묘를 정식하여 8월 중순경에 수확을 하였고, 콩의 재배는 6월중순에 묘를 정식하여 10월 하순에 수확하였다.
묘를 정식하기 약 3주 전에 토양을 채취하여 화학성 분석을 수행한 후 각 작물에 맞는 시비량을 흙토람(soil.rda.go.kr)의 비료사용 처방 서비스를 이용하여 검정시비량을 확인한 후 요소(질소 46%, 풍농), 용성인비(인산 17%, 풍농), 염화칼리(칼리60%, 풍농)를 각 시비량에 맞춰 정식 일주일 전에 경운 작업을 하면서 포장에 투입하였으며, 이 때 퇴비는 투입하지 않았다. 토양의 채취 방법 및 조사 방법은 2.2토양 이화학성 조사 분석에서 자세히 기술하였다.
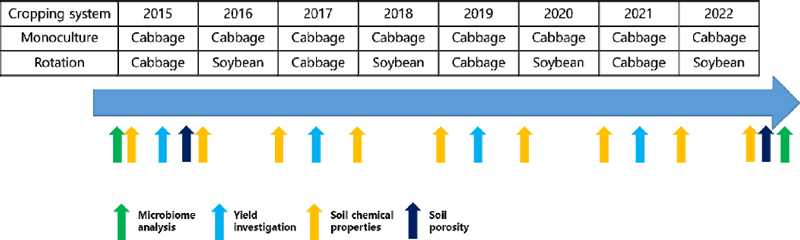
재배관리는 경운작업 후 75 cm 간격으로 이랑을 만든 후 흑색 비닐로 멀칭을 하였고, 병해충 방제를 위해 기후와 포장 상태를 확인해가며 살충제 및 살균제를 처리하면서 관리하였다. 매년 같은 품종을 재배하였으며, 배추는 수호 품종으로 재식간격은 35 cm, 콩은 대풍 품종으로 15 cm 간격으로 정식하였다. 관수는 토양과 작물상태에 따라 필요 시 수행하였다. 작부처리는 배추 이어짓기와 배추-콩 돌려짓기의 두 가지 작부로 시험구의 크기 및 배치는 4 m x 6 m 시험구를 처리 당 3반복으로 랜덤배치하였다. 각 년도에 따른 작물의 재배 및 토양 이화학성 및 미생물상, 그리고 배추 수량조사 시기를 Fig. 1.에 표시하였다.
2.2. 토양 이화학성 조사 분석
토양 물리성은 토양 삼상을 조사함으로써 분석하였는데, 첫번째 작물이 재배되고 2016년 4월 경운작업 전과 8번째 작물을 재배한 후인 2022년 작물 수확 후 1달 정도 지난 후에 토양을 채취하여 분석을 수행하였다. 토양의 채취는 100 cm3 코어(core)를 이용하여 시험 토양의 표토(10-15 cm)와 심토(20-25 cm)를 각 시험구 별로 3반복으로 채취하여 105°C에서 이틀 간 건조 후 무게를 측정하여 용적밀도 및 토양공극률을 구하였다. 이 때 입자밀도는 국내 밭 토양의 평균인 2.65 Mg/m3을 적용하여 고상률을 계산하였다. 용적밀도, 토양 공극률 및 고상률은 아래의 식을 이용하여 산출하였다.
- 용적밀도 (g/mL) = (건토 무게)/100 (1)
- 토양 공극률(%) = 100-(토양 고상률) (2)
- 토양 고상률(%) = 용적밀도 x 2.65 (3)
토양 화학성은 매년 4월 하순에 포스트 홀 핸드 오거(auger)를 사용하여 표토에 해당하는 5-15 cm 깊이로 채취하였으며, 한 시험구에서 5개 지점을 무작위로 채취하여 시료봉투에 넣은 후 잘 섞어주었다. 채취한 시료는 직사광선이 들어오지 않는 장소에서 48시간 이상 건조시킨 후 2 mm 체로 쳐서 토양 분석에 사용하였다. 토양 화학성 분석 항목은 pH, 유기물, 유효인산, 치환성 양이온(K+, Ca2+, Mg2+)으로 각 시험구 당 3반복으로 측정하였으며, 농업과학기술원 토양 및 식물체 분석법(NIAST, 2002)에 준하여 다음의 방식으로 분석하였다. pH는 초자전극법으로 토양과 물을 1:5로 섞은 후 pH meter(Orion Versa Star Pro, Thermo Scientific, Massachusetts, USA)로 측정하였고, 유기물함량은 Vario Max(Hanau, Germany) CN으로 탄소 함량을 측정한 후 환산하였고, 유효인산함량은 Lancaster 방법에 따라 UV 720 nm(UV/VIS spectrometer, Lamda 25, Perkinelmer Co., Norwalk, CT, USA)에서 측정하였으며, 치환성 양이온 함량은 토양 샘플을 1M의 NH4OAc 추출액으로 침출한 여과액을 유도결합질량분석기(Optima 2100DV, PerkinElmer Co., Norwalk, CT, USA)로 분석하였다.
2.3. 토양 미생물군집 분석
처리에 따른 토양 미생물군집은 2015년 처음 작물을 재배하기 전과 2022년 8번의 작물을 재배한 후에 토양시료를 4월 말에 채취하여 세균 및 곰팡이의 미생물 군집을 분석하여 처리에 따른 미생물군집 간의 차이를 규명하고자 하였다. 토양 시료의 채취는 모종삽을 이용하여 5-15 cm 깊이로 한 시험구에서 5 지점에서 토양을 채취하여 시료 봉투에 넣어서 잘 섞어주었으며, 한 처리의 시료 채취가 끝나면 70% 에탄올로 모종삽을 소독하였다. 채취한 토양은 DNA 추출 전까지 -80°C 냉동고에 보관하였다. 시험 전은 5 반복으로 시험 후 각 처리는 3 반복으로 DNA 추출 키트(ISOIL for beads beating DNA extraction kit, Nippongene, Japan)로 제조사의 매뉴얼에 따라 DNA를 추출하였으며, 추출한 DNA는 -20°C에 냉동 보관하여 시험에 사용하였다. 세균의 군집 분석을 위해 V4 부위를 16S rRNA specific primer를 통해 증폭시켰으며, 곰팡이 군집 분석을 위해 ITS1 부위를 ITS specific primer를 통해 증폭시켰고, 사용한 primer들의 정보는 다음과 같다.
- 16S 515F: 5’-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG-GTGCCAGCMGCCGCGGTAA-3’
- 16S 806R: 5’-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG-GGACTACHVGGGTWTCTAAT-3’
- ITS1F: 5’-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG-CTTGGTCATTTAGAGGAAGTAA-3’
- ITS2R: 5’-GTCTCGTGGGCTCGGAGATGTGTATA AGAGACAG-GCTGCGTTCTTCATCGATGC-3’
타겟 부위를 증폭시키기 위해 PCR을 수행하였으며, PCR을 할 때 사용한 premix는 Amplitaq GOLD(Applied biosystems, Carlsbad, CA, USA)였고, 온도 조건은 1) 95°C 10분, 2) 95°C 30초, 3) 55°C 30초, 4) 72°C 1분으로 2)-4) 과정을 30 cycle 반복하였다. 증폭된 샘플은 Macrogen(Seoul, South Korea)에 의뢰하여 Miseq 플랫폼(Illumina Co., California, USA)을 통해 미생물군집 분석을 수행하여 DADA2를 이용하여 denoising과정을 거쳤으며, NCBI 데이터베이스를 토대로 taxonomic assignment작업을 진행하여 결과 파일로 제공되었다.
이후, 미생물군집데이터의 분석은 R 프로그램(4.3.1)의 phyloseq package와 microbiome package를 이용하여 α-diversity와 core heatmap analysis를 수행하였으며, labdsv package를 이용하여 indicator taxa analysis를 수행하였다. 얻어진 indicator ASV들의 matrix에서 9 이상의 frequency를 보이는 ASV들을 선발하였다. Core heatmap analysis에서 Core ASV들의 선발은 세균 군집의 경우 0.002의 detection과 0.5의 prevalence 수준으로 곰팡이 군집의 경우 0.008의 detection과 0.5의 prevalence수준으로 각 12개, 13개의 ASV들을 선발하여 동정이 되는 수준에서 분석을 수행하였다. 각 처리의 세균 및 곰팡이 군집의 relative abundance는 Excel 프로그램을 통해 세균은 Phylum 수준으로 곰팡이는 Class 수준으로 처리에 따른 데이터를 정리하여 그래프를 생성하였다. PCoA analysis(weighted unifrac)는 마크로젠에서 제공한 플랫폼을 이용하여 Emperor를 통해 3개의 축을 보이는 3D로 생성하였다.
2.4. 배추 수확 조사
배추의 수량 조사는 농촌진흥청 농업과학기술 연구조사분석기준(RDA, 2012)에 준하여 수행하였다. 배추의 수확시기인 정식 후 70일 후 한 시험구에서 10개체씩 처리 당 총 30개체를 조사하였는데, 해당 시험구에서 평균적인 생육을 보이며 병해충의 피해를 받지 않은 배추를 선발하여 조사대상으로 하였으며, 구를 감싸고 있는 겉잎도 포함한 총 무게를 측정한 후 10a 기준으로 환산하였다.
2.5. 통계 분석
본 시험에서 수행한 통계 분석은 R(4.3.1)을 이용하였으며, R의 기본 패키지 프로그램을 이용하여 t-분석과 분산분석을 통해 통계적 유의성을 검정하였으며, 분산분석 후 5% 수준 이하에서 유의성이 인정이 되면 agricolae 패키지를 사용하여 bonferroni 분석으로 사후검정을 수행하였다.
3. 결과 및 고찰
3.1. 배추 이어짓기 및 돌려짓기 작부에 따른 토양 이화학성 변화
이어짓기와 돌려짓기 시험구 모두 첫번째 작물로 동일하게 배추를 재배한 후 두번째 작물 재배 전의 채취한 토양과 8번의 재배를 마친 후의 표토와 심토의 용적밀도를 비교하였다(Table 1). 그 결과 표토에서는 8년간 재배를 끝난 후에는 첫번째 재배 후와 비교하여 두작부처리 모두에서 나지와 비슷한 수준으로 용적밀도가 약간 증가하였다. 심토의 경우는 첫번째 재배 후와 비교하여 8년간 재배를 끝낸 후 나지와 배추 이어짓기 시험구에서는 유의한 변화가 없었으나 배추와 콩 돌려짓기 시험구에서는 심토의 용적밀도가 유의한 수준으로 감소하였다.
토양 공극률 시험 결과도 용적밀도의 결과를 뒷받침하였는데, 두번째 작물 재배 전의 표토의 공극률은 나지와 비교하여 작물을 재배하였던 시험구에서 처리에 따른 차이 없이 높은 공극률을 보였으나 8년간 재배를 계속하여 수행한 후에는 두 작부처리 모두 표토의 공극률이 나지와 유의한 차이가 없는 수준으로 감소하였다. 그러나 심토의 공극률은 두번째 작물 재배 전에는 나지와 두 작부처리의 공극률이 비슷한 수준이었으나 8번 재배 후에는 비록 두 작부처리 간의 유의한 차이는 없지만 나지와 비교하여 작물을 재배하였을 시 심토의 공극률이 유의한 수준으로 증가하였음을 확인할 수 있었다(Fig. 2.).
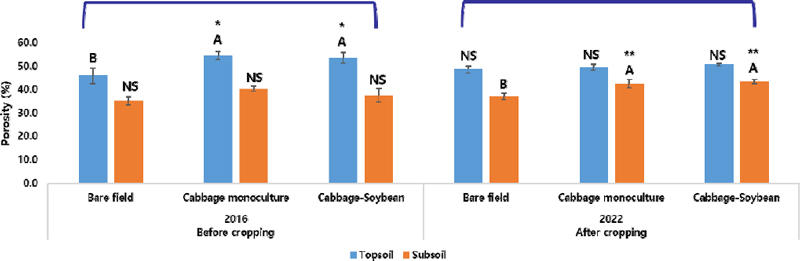
Soil porosity comparisons in different cropping systems and after 8 years of cultivation (ANOVA for Topsoil and Subsoil in bare field, monoculture and rotation, NS: no significance, *p-value < 0.05, **p-value < 0.01).
토양의 용적밀도가 1.5 Mgm-3 이상에서는 작물의 생육이 불량할 수 있으며, 용적밀도가 1.1-1.6의 범위에서는 용적밀도가 증가할수록 작물의 생육량이 감소하였다는 보고가 있다(Kim et al., 2010). 배추와 콩의 뿌리 발달은 환경에 따라 차이는 있지만 국내에서 표준시비법으로 작물을 재배한 선행연구 결과 배추의 근권 깊이는 19-29 cm, 콩은 27-32 cm 범위로 보고하였으며, 최대 신장 깊이는 사양토 기준으로 배추는 58 cm콩은 56 cm 로 관찰되어 두 작물이 큰 차이를 보이지 않았다(Zhang et al., 2017). 본 시험에서 표토는 10-15 cm 깊이, 심토는 20-25 cm 깊이의 토양을 채취하여 분석하였는데, 8년 간의 작물 재배 후 심토에서 두 작부처리 모두 나지와 비교하여 공극률이 증가하였다. 특히 배추와 콩 돌려짓기 시험구에서 심토의 용적밀도가 감소한 결과는 작물에 따른 뿌리 발달 특성의 차이 뿐 아니라 토양 유기물, 관개 등을 포함한 재배 환경의 영향도 배제할 수 없다고 판단된다(Marinari et al., 2000; Kaduyu and Musinguzi, 2021).
작부체계에 따른 토양 화학성 변화 결과는 Fig. 3.에 나타내었다. 전반적으로 재배기간이 길어짐에 따라 pH와 토양 내 양분이 감소하는 경향을 보였으며, 작부처리에 따른 토양화학성 요소들의 차이는 특정 연도에서는 유의한 차이를 확인할 수 있었으나 편차를 고려하였을 때 작부처리에 따른 차이는 미비한 것으로 생각이 된다. 농경지에서 토양의 이화학성은 토양환경, 피복작물의 양, 무기화된 정도 등에 따라 단기적으로는 감소하거나 증가하지만 장기적인 변화는 크게 영향을 받지 않는다고 하여 본 시험의 결과와 일치하는 보고가 있었다(Yang et al., 2011). 장기간 이어짓기를 하면 돌려짓기와 비교하여 토양 내 특정 양분이 결핍되거나 축적되는데(Deligios et al., 2017), 본 시험에서는 퇴비를 투입하지 않고 검정시비를 통해 각 작물의 생장에 필요한 비료의 양을 측정하여 투입하였기 때문에 이어짓기에 따른 양분의 불균형은 확인할 수 없었던 것으로 판단된다.
3.2. 배추 이어짓기 및 돌려짓기 작부에 따른 배추 생산성 비교
돌려짓기와 이어짓기 작부처리에 따라 8년간 작물을 재배하면서 배추 재배시기가 겹치던 해의 배추 생산량을 조사하여 처리 간의 차이를 비교 분석한 결과 전반적으로 유의한 생산량의 차이를 보이지는 않았으나, 모든 조사 연도에서 이어짓기 재배구와 비교하여 돌려짓기 재배구에서 더 높은 수량을 보였다(Fig. 4.). 토양 공극률, 용적밀도, 유기물, pH 등을 포함한 토양 이화학성은 작물의 생산력과 밀접한 관련이 있으며, 장기적인 관점에서 안정적인 작물생산을 위해서는 경운, 유기물 관리, 작부체계 개선, 토양 보전, 토양 내 미생물 다양성 증진 등을 통해 토양의 질을 관리해야 한다(Lal, 2003).
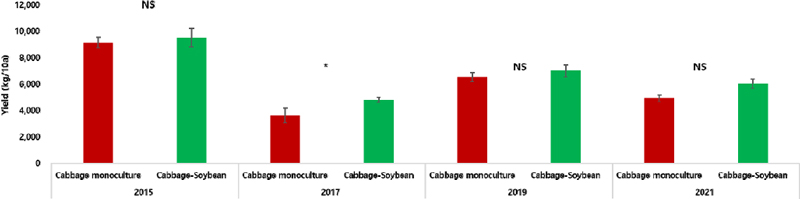
The comparisons of kimchi cabbage yield between monoculture and rotation with soybean (t-test, NS: no significance, *p-value < 0.05).
작부체계가 토양 이화학성 및 작물 생산성에 미치는 영향은 토성, 재배 작물 그리고 재배 년수 등에 따라 차이가 있지만 돌려짓기 시 작물의 생산성이 20%까지 증가할 수 있다(Zhao et al., 2020). Bak and Lee(2021)의 연구에서도 배추 재배 시 감자, 콩과의 돌려짓기 시험구에서 배추 이어짓기 시험구보다 높은 생산성을 보였으며, 배추와 같은 십자화과에 속하는 유채의 재배에서도 휴한기간과 돌려짓기 작물에 따라 생산량은 달랐으나 이어짓기와 비교하여 돌려짓기 시험구에서 높은 생산량을 확인하여(Hegewald et al., 2018), 배추 재배 시 돌려짓기를 수행하면 작물과 환경에 따라 증수의 차이는 있겠으나 이어짓기와 비교하여 높은 수량을 얻을 수 있다고 생각된다.
3.3. 배추 이어짓기 및 돌려짓기 작부에 따른 미생물군집 비교 분석
배추 작부체계에 따른 세균 및 곰팡이 군집의 다양성은 다양성을 나타내는 3개 지표를 사용하여 Fig. 5.에 나타내었다. 세균과 곰팡이 군집 모두 이어짓기와 비교하여 돌려짓기 시험구에서 더 높은 다양성을 나타냈으며, 세균 군집의 경우는 작부처리와 상관 없이 작물의 재배 후 다양성이 감소하는 경향을 보였는데, 특히 이어짓기 처리구에서 유의하게 낮은 다양성을 보였다. 곰팡이 군집의 경우 세균 군집과 비교하여 편차가 큰 편으로 처리 간 유의성은 없었으나 군집 구성원들의 풍부도를 고려한 Simpson 지표에서 돌려짓기 및 이어짓기 미생물군집의 반복 간 편차가 감소하여 작물의 재배와 작부의 영향을 받는 곰팡이 미생물군집이 있음을 추측할 수 있었다. 작물의 재배와 작부처리가 미생물군집 구성에 유의한 영향을 주는 것은 PCoA 분석 결과를 통해서도 알 수 있다(Fig. 6.). PCoA 분석 결과 작물의 재배 및 작부처리에 따라 세균군집에서는 PC1이 86.24%, PC2가 4.5%, PC3가 2.79%의 설명력을 보였으며, 곰팡이 군집에서는 PC1이 43.19%, PC2가 18.92%, PC3이 13.72%의 설명력을 보이며 각 처리의 미생물군집의 구성원과 풍부도를 고려하였을 때 집단화되는 것을 확인할 수 있었다.
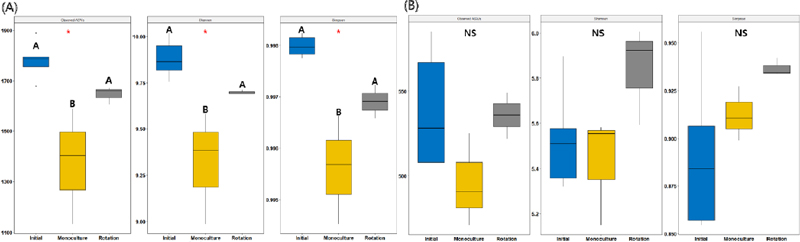
The comparisons of bacterial(A) and fungal(B) diversity according to cropping systems (ANOVA, NS: no significance, *p-value < 0.05, **p-value < 0.01).
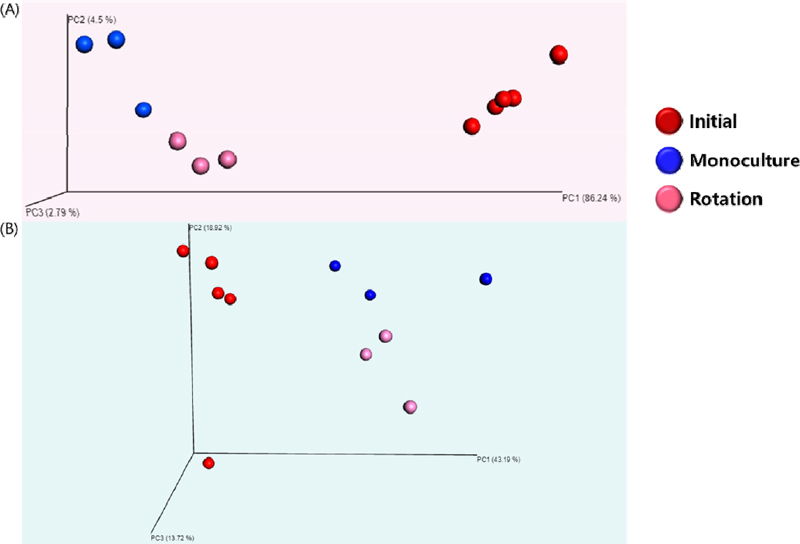
The PCoA analysis of two cropping systems according to bacterial(A) and fungal(B) communities (weighted unifrac).
토양의 미생물군집은 여러가지 요인의 영향을 받으며, 작부체계가 작물의 토양 미생물군집에 미치는 영향에 대해서 밀(Town et al., 2022), 쌀(Lu et al., 2018), 옥수수(Benitez et al., 2017), 수수(Oberholster et al., 2018), 토마토(Samaddar et al., 2021), 유채(Town et al., 2023) 등을 포함한 다양한 작물에서 연구가 수행되었다. 작부체계에 따른 미생물 군집 연구는 장기적으로 돌려짓기를 수행했을 때의 토양 미생물군집의 변화(Lu et al., 2018; Town et al., 2022), 전작물의 종류에 따른 미생물군집의 비교(Benitez et al., 2017; Samaddar et al., 2021), 그리고 작부체계 뿐 아니라 재배 지역과 토성이 다른 경우(Oberholster et al., 2018; Town et al., 2023) 등 다양한 요인을 고려하여 연구가 수행되었다. 그 결과, 대부분의 경우 세균과 곰팡이 군집 모두에서 미생물 다양성 수준은 작부처리에 따른 유의한 차이를 찾기 어려워 본 시험의 결과와 일치하는 경향을 보였다. 그러나 다양성 수준이 작부처리에 따라 유의한 차이가 나지 않을지라도 작부처리가 비근권토양 및 근권토양의 미생물 군집 구성에 유의한 영향을 준다고 위 연구들에서 보고되었다.
배추 작부처리에 따른 미생물군집의 특성을 비교한 선행연구에서도 돌려짓기 작부가 근권 토양의 미생물군집의 구성에 유의한 영향을 준다고 보고되어 본 연구의 결과와 일치하는 경향을 보였다(Bak et al., 2022; Jinhao et al., 2022). 선행연구에서는 화분에서 작물을 재배하여 배추 생육기에 따라 근권 토양의 미생물군집을 분석한 결과 배추 이어짓기 처리구보다 콩, 감자와 돌려짓기 처리구에서 세균과 곰팡이 군집 모두 유의하게 높은 미생물 다양성을 나타내었다(Bak et al., 2022). 본 시험은 재배 기간 내내 특정한 병의 발병을 관찰할 수 없었던 일반 농경지 포장에서 배추를 수확하고 6개월 이상이 지난 후 비근권 토양을 채취하여 수행되었기 때문에, 작물의 영향보다는 환경의 영향을 더 많이 받았을 것으로 생각이 된다. 선행연구와는 다르게 곰팡이 군집에서 작부처리에 따른 미생물 다양성의 유의한 차이를 확인하기 어려웠던 것도 위 요인과 관련이 있을 것으로 생각된다. 그러나 곰팡이 군집에서도 이어짓기 시험구와 비교하여 돌려짓기 시험구에서 높은 다양성을 보였기 때문에 배추를 장기적으로 재배할 경우 이어짓기와 비교하여 돌려짓기 시험구에서 더 높은 미생물 다양성을 근권토양 뿐 아니라 비근권 토양에서도 관찰할 수 있을 것으로 판단된다.
8년 간 배추를 이어짓기하였을 때와 콩과 돌려짓기하였을 때의 토양 세균 및 곰팡이 미생물 군집을 분석하였다. 그 결과 세균 군집에서는 작물을 재배한 후 작부처리와 상관 없이 Acidobacteriota, Bacteroidota, Pseudomonadota, Verrucomicrobiota가 감소하고 Actinomycetota, Bacillota, Planctomycetota가 증가하였으며, 특히 이어짓기 처리에서는 Chloroflexota가 높은 상대풍부도를 보였으며, 돌려짓기 처리에서는 Pseudomonadota가 높은 함량을 보였다(Fig. 7A.). 곰팡이 군집에서는 작물을 재배하였을 때 작부처리와 관계 없이 Sordariomycetes, Mortierellomycetes가 감소하고 Eurotiomycetes가 증가하였으며, 돌려짓기처리에서는 이어짓기 처리구보다 약 5배 높은 Dothideomycetes를 확인할 수 있었고, 이어짓기 처리에서는 Eurotiomycetes와 Agaricomycetes가 돌려짓기 처리구와 비교하여 약 3배 높은 비율을 차지하고 있었다(Fig. 7B.).
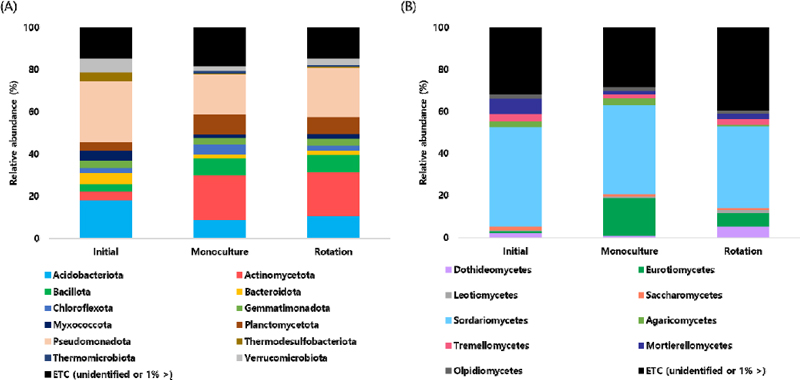
The relative abundance of bacterial(A) and fungal(B) communities according to cropping systems described in phylum and class level, respectively.
토양 내 유기물 수준은 미생물군집에 중요한 영향을 주는데(Pankaj et al., 2017), 유기물 함량이 낮을수록 Acidobacteria, Chloroflexi, 그리고 Verrucomicrobia와 같은 oligotrophic bacteria가 증가하고, 유기물 함량이 높으면 Proteobacteria, Bacteroidetes, Actinobacteria와 같은 copiotrophic bacteria가 증가한다고 알려져 있다. 또한, 자연상태의 토양과 비교하여 농경지 토양에서는 곰팡이 군집의 Ascomycota가 증가하고 Basidiomycota가 감소하였다(De Castro et al., 2008).
본 시험에서는 비록 퇴비는 투입하지 않아 시험 전과 비교하여 유기물 함량이 크게 증가하지는 않았으나, 작물을 재배한 시험구들은 매년 경운을 수행하였고, 토양 화학성 분석 결과에 기반하여 계산된 화학비료가 투입되었으며, 재배 작물의 잔재물을 일부러 남겨두지는 않았으나 작물이 생장하면서 식물의 뿌리나 잎 등이 자연스럽게 토양 내에 투입이 되었다. Proteobacteria, Firmicutes, Actinobacteria, 그리고Bacteroidetes는 최근에 각각 Pseudomonadota, Bacillota, Actinomycetota 그리고 Bacteroidota로 이름이 바뀌었기 때문에(Robitzski, 2022) 선행연구 결과와 본 시험의 결과를 비교할 때 이를 고려하여 고찰을 수행하였다.
본 시험 결과에서는 작부체계와 상관없이 8년의 작물 재배 후 copiotrophic bacteria로 알려진 Pseudomonadota, Bacteroidota, Actinomycetota중 Actinomycetota만 증가하였고, Pseudomonadota와 Bacteroidota는 감소하였다. 곰팡이 군집에서는 농경지에서 증가한다고 알려진 Ascomycota에 속하는 Eurotiomycetes와 Sordariomycetes가 상반된 결과를 보였는데, 작물 재배 후 Eurotiomycetes는 증가하였으나 Sordariomycetes는 감소하였다. 본 시험은 선행연구들과 다른 환경과 다른 작물을 이용하여 수행되었으며, phylum과 class 수준에서의 분석은 다양한 미생물들을 포함하고 있기 때문에 일부 결과는 선행연구와 일치하였으나 일부 결과는 선행연구 결과로 설명하기 어려운 부분이 있으므로, 추가적으로 genus와 species 수준으로 분석을 수행하여 미생물군집의 차이를 비교하고자 하였다.
Indicator taxa analysis를 통해 각 작부 처리에서 통계적으로 유의하게 높은 풍부도를 보이는 ASV들을 확인할 수 있었는데, 이어짓기 처리구에서는 3개의 세균 ASV와 4개의 곰팡이 ASV가 선발되었고, 돌려짓기 처리구에서는 5개의 세균 ASV와 9개의 곰팡이 ASV가 선발되었다(Table 2). 이어짓기 시험구에서 선발된 7개의 ASV들 중 특히 Ktedonobacter racemifer, Penicillium 속에 속하는 ASV, 그리고 Fusarium oxysporum이 돌려짓기 시험구와 비교하여 높은 상대 풍부도를 보여 배추 이어짓기와 관련이 큰 미생물들일 가능성이 높음을 추측할 수 있었다. 돌려짓기 시험구에서는 곰팡이 군집의 경우 동정이 되지 않은 몇몇 ASV들이 확인이 되었으나 Pseudarthrobacter phenanthrenivorans, Emericellopsis minima가 높은 상대 풍부도를 보여 콩과의 돌려짓기 작부가 이들과 관련이 있을 것으로 판단이 되었다.
이어짓기 작부의 indicator로 선발된 Ktedonobacter racemifer는 화분에서 배추를 7번 연속 재배한 Bak et al.,(2022)의 연구에서도 Ktedonobacteraceae family가 배추 이어짓기 시험구의 근권 토양에서 유의하게 높은 풍부도를 보여 배추를 연속해서 재배할 경우 근권 및 비근권 토양에서 증가할 가능성이 높다고 생각된다. 그러나 선행연구의 곰팡이 군집 분석 결과 본 시험의 이어짓기 시험구에서 높은 상대풍부도를 보인 Fusarium oxysporum과 Penicillium 속의 유의한 증가를 확인할 수 없었다.
비록 모든 Fusarium oxysporum이 병원성인 것은 아니지만 F. oxysporum에 속하는 몇몇 strain들은 배추에서 시들음병을 유발하는 병원균으로 배추를 이어짓기하였을 때 밀도가 증가하여 병 발생이 증가한다고 보고된 바가 있다(Moon et al., 2001). 그러므로 본 연구에서 F. oxysporum이 이어짓기 시험구에서 유의하게 증가하여 indicator로 선발된 결과는 선행연구와 일치하는 결과로 생각된다. 그러나 Penicillium 속이 Fusarium 속과 함께 배추 이어짓기 시험구의 indicator로 선발된 본 연구 결과는 땅콩, 토마토 등에서 Penicillium 속이 병원성 Fusarium을 억제한다고 보고한 몇몇 선행연구들과(Sabuquillo et al., 2009; Li et al., 2020) 일치하지 않는 결과로 Penicillium이 배추의 연속 재배와 관련이 있는지 판단하기 위해서는 추가적인 시험과 분석이 필요할 것으로 생각된다.
콩과의 돌려짓기 시험구의 indicator로 선발된 Pseudarthrobacter phenanthrenivorans와 Emericellopsis minima에 대해서 콩을 재배하는 농경지와 관련된 선행연구는 현재까지는 보고되지 않았으나 creosote로 오염된 토양에서 분리된 P. phenanthrenivorans Sphe3가 페놀의 생분해능이 있다고 보고가 되어(Asimakoula et al., 2023) 본 연구에서 콩돌려짓기 작부의 indicator로 선발된 P. phenanthrenivorans도 농경지 내 유기물 분해와 관련이 있을 가능성을 시사하였다.
작부체계에 따른 core ASV들의 풍부도를 비교한 결과도 indicator taxa analysis의 결과를 뒷받침하였다(Fig. 8.). Core ASV 분석은 특정 처리 뿐 아니라 샘플 전체를 고려하였을 때 우점적으로 존재하는 ASV들을 세균과 곰팡이 군집에서 각 12개, 13개를 선발하여 작부처리에 따라 풍부도의 차이가 있는지를 분석하였다. 그 결과 세균의 core ASV 분석(Fig. 8A.)에서는 Ktedonobacter racemifer가 배추 이어짓기 시험구에서 돌려짓기 시험구나 시험 전 토양보다 상당히 높은 풍부도를 보임으로써 indicator 분석결과와 일치하였다. 콩과의 돌려짓기 시험구에서는 Bradyrhizobium stylosanthis가 이어짓기 시험구와 비교하여 높은 풍부도를 보였다.
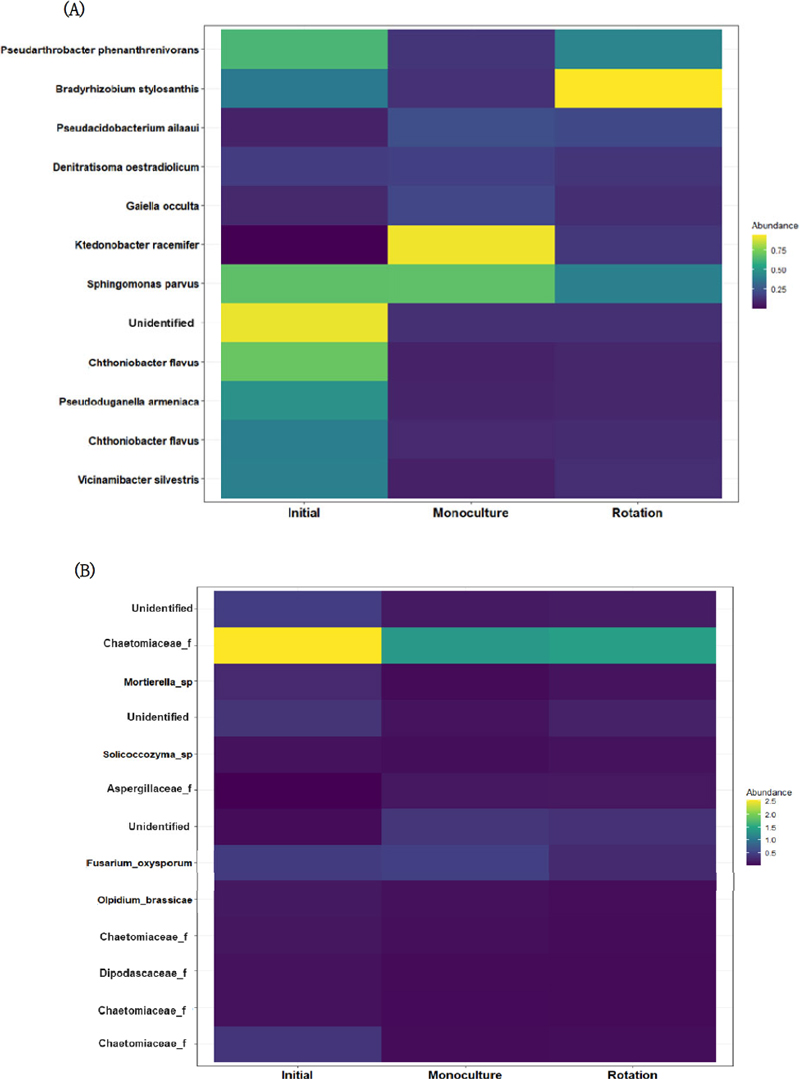
Heatmap of bacterial(A) and fungal(B) core ASVs according to cropping systems (bacterial core ASVs were selected with 0.002 of detection and 0.5 of prevalence, fungal core ASVs were selected with 0.008 of detectino and 0.5 of prevalence).
Morris et al.(1998)의 연구에서는 콩의 뿌리에서 분비되는 isoflavones의 영향으로 콩의 근권에는 Bradyrhizobium japonicum 이 발견되며, 콩 근권의 핵심 미생물 군집을 분석한 선행 연구에서도 Bradyrhizobium genus에 속하는 OTU가 콩의 근권 미생물 군집에서 높은 비율을 차지하고 있다고 보고하여(Lee et al., 2015) Bradyrhizobium genus가 콩과 밀접한 연관이 있음을 시사하였다.
곰팡이 군집의 core ASV 분석 결과에서는 데이터베이스가 아직까지는 부족하여 상당 수의 ASV들이 동정이 되지 않아 추후 데이터베이스가 갱신됨에 따라 다시 분석을 해 볼 필요가 있다고 판단된다. 현재의 데이터베이스를 토대로 core ASV 분석을 수행한 결과 선발된 ASV들 간에서는 작부체계에 따른 눈에 띄는 차이를 보이지 않았으나(Fig. 8B.), 13개의 ASV들 중에 Chaetomiaceae Family에 속하는 ASV가 4개나 확인되었고, 배추, 양배추, 브로콜리 등에서 병을 일으키는 병원균으로 알려져 있는 Olpidium brassicae를 확인할 수 있었으며, 이어짓기 시험구의 indicator로 선발되었던 F. oxysporum 도 core ASV로 선발되어 이어짓기 시험구에서 돌려짓기 시험구보다 약간 높은 풍부도로 존재함을 확인할 수 있었다.
F. oxysporum은 indicator taxa analysis에서도 이어짓기 시험구에서 약 8% 정도 상대 풍부도로 약 4%인 돌려짓기 시험구보다 2배 가까이 높은 상대풍부도를 보였다. 본 연구결과에서는 작부처리에 따른 O. brassicae의 풍부도의 유의한 증가를 확인하지는 못했으나 배추와 같은 십자화과로 알려진 유채에서도 이어짓기를 하였을 때 O. brassicae가 유의하게 증가하였다는 보고가 있어(Hilton et al., 2013; Bennett et al., 2014) 보다 장기적으로 배추를 이어짓기할 경우 토양 내 밀도가 증가할 가능성이 높다고 판단된다.
장기적인 관점에서 돌려짓기 재배는 이어짓기 재배와 비교하여 근권 토양에 유용한 미생물이 구성되어 토양 내 양분 순환 등을 보조할 수 있기 때문에 적절한 조합의 돌려짓기 작부는 작물이 이용할 수 있는 양분의 이용도를 증진시켜 작물의 생산성을 증가시킬 수 있다고 알려져 있다(Ryan et al., 2009; Guiñazú et al., 2010). 본 연구에서도 4번의 배추 생산성 조사 시기 중 한 번만 돌려짓기 시험구에서 유의하게 높은 수량을 보였으며, 나머지 세 번의 조사 시기에서도 유의성은 없었으나 돌려짓기 시험구에서 높은 수량을 보였다.
두 작부처리의 미생물군집 비교 결과 콩과의 돌려짓기 작부에서 콩과 연관성인 높은 것으로 추측되는 Bradyrhizobium stylosanthis가 돌려짓기 작부의indicator 로 선발되었으며, B. stylosanthis는 질소 고정 공생균으로 알려져 있어(Delamuta et al., 2016) 돌려짓기 작부에서의 배추의 높은 생산성에 기여하였을 것으로 생각된다. 또한, 시험 기간 동안 특별한 병의 발생은 확인할 수 없었으나 배추 이어짓기 시험구에서 F. oxysporum의 밀도가 유의하게 증가하여 이어짓기 시험구에서 추후 토양 전염성 병의 발병으로 배추 재배에 어려움을 겪을 수 있음을 시사하였다.
4. 결 론
본 시험에서는 8년간 고랭지 배추를 이어짓기로 재배하였을 때의 작물의 생산성, 토양 이화학성 및 토양 미생물군집의 변화를 콩과 배추를 돌려짓기하였을 때와 비교하여 장기간 이어짓기를 하는 작부 형태가 배추 생산성 및 토양에 미치는 영향을 분석하였다. 그 결과, 콩과의 돌려짓기 처리구에서는 배추 이어짓기 처리구와 비교하여 심토의 공극률이 약간 증가하였으나 두 작부처리의 토양 이화학성 요인들의 유의한 차이는 확인할 수 없었다. 배추의 생산성도 이어짓기 시험구보다 돌려짓기 시험구에서 4번의 조사 년도 모두 높은 수량을 보였으나 유의한 차이를 보이지는 않았다. 그러나 토양 미생물군집은 세균과 곰팡이 군집 모두 돌려짓기 시험구에서 다양성이 증가하였으며, 돌려짓기 시험구에서는 콩과 관련이 있는 것으로 추정되는 질소고정 공생균이 유의하게 높은 밀도로 확인되었고, 이어짓기 시험구에서는 배추에 병을 일으킬 수 있는 병원균이 높은 밀도로 존재함을 알 수 있었다. 그러므로 배추와 콩을 돌려짓기하면 배추 이어짓기와 비교하여 토양 이화학성에는 큰 차이가 없을지라도 유용미생물의 증진 및 병원성 미생물의 밀도를 낮춤으로써 장기적으로 고랭지 배추의 안정 생산에 기여할 수 있을 것으로 기대한다.
Acknowledgments
이 논문은 농촌진흥청 연구사업 “고랭지 배추 반쪽 시들음병 발병지 토양환경 분석 및 친환경 방제기술 개발”(과제번호: PJ016805022023)에 의해 지원되었음.
REFERENCES
-
Asimakoula, S., Marinakos, O., Tsagogiannis, E., Koukkou, A. I., 2023, Phenol degradation by Pseudarthrobacter phenanthrenivorans Sphe3, Microorganisms, 11(2), 524.
[https://doi.org/10.3390/microorganisms11020524]

- Bak, G. R., Lee, J. T., 2021, Effect of napa cabbage( Brassica campestris var. Pekinensis) cropping systems on soil physiochemical properties, yield and quality in alpine area of South Korea, Korean J. Plant Res., 34(4), 249-256.
-
Bak, G. R., Lee, G. J., Lee, J. T., Jee, S. N., 2022, Crop rotation affects biological properties of rhizosphere soil and productivity of Kimchi cabbage( Brassica rapa ssp. pekinensis) compared to monoculture, Hortic. Environ. Biotechnol., 63, 613-625.
[https://doi.org/10.1007/s13580-021-00411-5]

-
Bano, S., Wu, X., Zhang, X., 2021, Towards sustainable agriculture: rhizosphere microbiome engineering, Appl. Microbiol. Biotech., 105, 7141-7160.
[https://doi.org/10.1007/s00253-021-11555-w]

-
Benitez, M. S., Osborne, S. L., Lehman, R. M., 2017, Previous crop and rotation history effects on maize seedling health and associated rhizosphere microbiome, Sci. Rep., 7, 15709.
[https://doi.org/10.1038/s41598-017-15955-9]

-
Bennett, A. J., Hilton, S., Bending, G. D., Chandler, D., Mills, P., 2014, Impact of fresh root material and mature crop residues of oilseed rape (Brassica napus) on microbial communities associated with subsequent oilseed rape, Biol. Fertil. Soils., 50, 1267-1279.
[https://doi.org/10.1007/s00374-014-0934-7]

-
Chen, S., Zhou, X., Yu, H., Wu, F., 2018, Root exudates of potato onion are involved in the suppression of clubroot in a Chinese cabbage-potato onion-Chinese cabbage crop rotation, Eur. J. Plant Pathol., 150, 765-777.
[https://doi.org/10.1007/s10658-017-1307-5]

-
De Castro, A. P., Quirino, B. F., Pappas, J. G., Kurokawa, A. S., Neto, E. L., Krüger, R. H., 2008, Diversity of soil fungal communities of Cerrado and its closely surrounding agriculture fields, Arch. Microbiol., 190(2), 129-139.
[https://doi.org/10.1007/s00203-008-0374-6]

-
Delamuta, J. R. M., Ribeiro, R. A., Araújo, J. L. S., Rouws, L. F. M., Zilli, J. É., Parma, M. M., Melo, I. S., Hungria, M., 2016, Bradyrhizobium stylosanthis sp. Nov., comprising nitrogen-fixing symbionts isolated from nodules of the tropical forage legume Stylosanthes spp., International journal of systematic and evolutionary Microbiology., 66(8).
[https://doi.org/10.1099/ijsem.0.001148]

-
Deligios, P. A., Tiloca, M. T., Sulas, L., Buffa, M., Caraffini, S., Doro, L., Sanna, G., Spanu, E., Spissu, E., Urracci, G. R., Ledda, L., 2017, Stable nutrient flows in sustainable and alternative cropping systems of globe artichoke, Agron. Sustain. Dev., 37(54).
[https://doi.org/10.1007/s13593-017-0465-3]

-
Gan, Y., Hamel, C., O’Donovan, J. T., Cutforth, H., Zentner, R. P., Campbell, C. A., Niu, Y., Puppy, L., 2015, Diversifying crop rotations with pulses enhances system productivity, Sci. Rep, 5(1), 14625.
[https://doi.org/10.1038/srep14625]

-
Guiñazú, L. B., Andrés, J. A., Del Papa, M. F., Pistorio, M., Rosas, S. B., 2010, Response of alfalfa (Medicago sativa L.) to single and mixed inoculation with phosphate-solubilizing bacteria and Sinorhizobium meliloti, Biol. Fertil. Soils., 46(2), 185-190.
[https://doi.org/10.1007/s00374-009-0408-5]

- HARI (Highland Agriculture Research Institute), 2000, Vegetable cultivation technology in highland, Pyeongchang, Korea, 52-53.
-
Hegewald H., Wensch-Dorendorf, M., Sieling K., Christen, O., 2018, Impacts of break crops and crop rotations on oilseed rape productivity: A review, Eur. J. Agron., 101, 63-77.
[https://doi.org/10.1016/j.eja.2018.08.003]

-
Hilton, S., Bennett, A. J., Keane, G., Bending, G. D., Chandler, D., Stobart, R., Mills, P., 2013, Impact of shortened crop rotation of oilseed rape on soil and rhizosphere microbial diversity in relation to yield decline, Plos one., 8(4), e59859.
[https://doi.org/10.1371/journal.pone.0059859]

- Jung, J. M., Yoon, B. K., Kim, H. J., Seo, Y. W., Yang, S. K., Choi, K. J., 2007, The effects on resources of soil amendment matters friendly-environment on the marketing for agriculture of Chinese cabbage, J. Bio. Environ. Cont., 16, 276-281.
-
Kaduyu, I., Musinguzi, P., 2021, Impact of irrigated and non-irrigated cropping systems on soil physicochemical properties in a small-scale irrigation farming system in Eastern Uganda, Arch. Agric. Environ. Sci., 6(3), 313-319.
[https://doi.org/10.26832/24566632.2021.060308]

- Kim, C. H., Cho, W. D., Kim, H. M., 2000, Distribution of Plasmodiophora brassicae causing clubroot disease of Chinese cabbage in soil, Plant Dis. Res., 6, 27-33.
- Kim, C. Y., Seo, Y. J., Kwon, T. Y., Park, J. H., Heo, M. S., Ha, S. K., 2010, Correlation between the factors of soil physical property in upland soil, Korean J. Soil. Sci. Fert., 43(6), 793-797.
-
Lal, R., 2003, Cropping systems and soil quality, J. Crop Prod., 8,1-2, 33-52.
[https://doi.org/10.1300/J144v08n01_03]

-
Lee, Y. M., Ahn, J. H., Choi, Y. M., Weon, H. Y., Yoon, J. H., Song, J. K., 2015, Bacterial core community in soybean rhizosphere, Korean J. Microbiol., 51(4), 347-354.
[https://doi.org/10.7845/kjm.2015.5052]

-
Li, J., Wang, C., Liang, W., Liu, S., 2021, Rhizosphere microbiome: The emerging barrier in plant-pathogen interactions, Front. Microbiol., 12, 772420.
[https://doi.org/10.3389/fmicb.2021.772420]

-
Li, P., Liu, J., Jiang, C., Wu, M., Liu, M., Wei, S., Qiu, C., Li, G., Xu, C., Li, Z., 2020, Trade-off between potential phytopathogenic and non-phytopathogenic fungi in the peanut monoculture cultivation system, Appl. Soil Ecol., 148, 103508.
[https://doi.org/10.1016/j.apsoil.2020.103508]

-
Lu, S., Lepo, J. E., Song, H. X., Guan, C. Y., Zhang, Z. H., 2018, Increased rice yield in long-term crop rotation regimes through improved soil structure, rhizosphere microbial communities, and nutrient bioavailability in paddy soil, Biol. Fertil. Soils., 54, 909-923.
[https://doi.org/10.1007/s00374-018-1315-4]

- MAFRA (Ministry of Agriculture, Foodand Rural Affairs), 2006, Statistical yearbook of agriculture and forestry, MAFRA, Seojong, Korea.
-
Marinari, S., Masciandaro, G., Ceccanti, B., Grego, S., 2000, Influence of organic and mineral fertilisers on soil biological and physical properties, Bioresour. Technol., 72(1), 9-17.
[https://doi.org/10.1016/S0960-8524(99)00094-2]

- Moon, Y. G., Kim, W. G., Cho, W. D., Sung, J. M., 2001, Occurrence of Fusarium wilt on cruciferous vegetable crops and pathogenic differentiation of the causal fungus, Res. Plant Dis., 7(2), 91-101.
-
Morris, P. F., Bone, E., Tyler, B. M., 1998, Chemotropic and contact responses of phytophthora sojae hypha to soybean isoflavonoids and artificial substrates, Plant Physiol., 114(4), 1171-1178.
[https://doi.org/10.1104/pp.117.4.1171]

- National institute of agricultural science and technology( NIAST), 2002, Methods of soil chemical analysis, RDA, Suwon, Korea.
-
Oberholster, T., Vikram, S., Cowan, D., Valverde, A., 2018, Key microbial taxa in the rhizosphere of sorghum and sunflower grown in crop rotation, Sci. Total Environ., 624, 530-539.
[https://doi.org/10.1016/j.scitotenv.2017.12.170]

-
Pankaj, T., Manuel, D. B., Thomas, C. J., Chanda, T., Ian, C. A., Kaitao, L., Matthew, M., Kenneth, F., Bhupinder, P. S., David, M., Brajesh, K. S., 2017, Soil aggregation and associated microbial communities modify the impact of agricultural management on carbon content, Environ. Microbiol., 19(8), 3070-3086.
[https://doi.org/10.1111/1462-2920.13779]

- RDA (Rural development administration)., 2012, Agricultural science and technology research survey analysis standard, Suwon, Korea.
- RDA (Rural development administration), 2021, Kimchi cabbage,7th ed., Jeonju, Korea, available in https://www.nonsaro.go.kr, , p9.
- Robitzski, D., Newly renamed prokaryote phyla cause up roar, 2022, The scientist, Available at: https://www.the-scientist.com/news-opinion/newly-renamed-prokaryote-phyla-cause-uproar-69578, .
-
Ryan, P. R., Dessaus, Y., Thomashow, L. S., Weller, D. M., 2009, Rhizosphere engineering and management for sustainable agriculture, Plant Soil., 321(1), 363-383.
[https://doi.org/10.1007/s11104-009-0001-6]

-
Sabuquillo, P., Sztejnberg, A., De Cal, A., Melgarejo, P., 2009, Relationship between number and type of adhesions of Penicillium oxalicum conidia to tomato roots and biological control of tomato wilt, Biol. Control., 48(3), 244-251.
[https://doi.org/10.1016/j.biocontrol.2008.11.001]

-
Samaddar, S., Schmidt, R., Tautges, N. E., Scow, K., Adding alfalfa to an annual crop rotation shifts the composition and functional response of tomato rhizosphere microbial communities, Appl. Soil Ecol., 167, 104102.
[https://doi.org/10.1016/j.apsoil.2021.104102]

-
Santos, L. F., Olivares, F. L., 2021, Plant microbiome structure and benefits for sustainable agriculture, Curr. Plant Biol., 26, 100198.
[https://doi.org/10.1016/j.cpb.2021.100198]

-
Town, J. R., Gregorich, E. G., Drury, C. F., Lemke, R., Phillips, L. A., Helgason, B. L., 2022, Diverse crop rotations influence the bacterial and fungal communities in root, rhizosphere and soil and impact soil microbial processes, Appl. Soil Ecol., 169, 104241.
[https://doi.org/10.1016/j.apsoil.2021.104241]

-
Town, J. R., Dumonceaus, T., Tidemann, B., Helgason, B. L., 2023, Crop rotation significantly influences the composition of soil, rhizosphere, and root microbiota in canola (Brassica napus L.), Environ. Microbiome., 18, 40.
[https://doi.org/10.1186/s40793-023-00495-9]

-
Tyagi, R., Pradhan, S., Bhattacharjee, A., Dubey, S., Sharma, S., Notes, A., 2022, Management of abiotic stresses by microbiome-based engineering of the rhizosphere, J. Appl. Microbiol., 133(2), 254-272.
[https://doi.org/10.1111/jam.15552]

-
Venter, Z. S., Jacobs, K., Hawkins, H. J., 2016, The impact of crop rotation on soil microbial diversity: a meta-analysis, Pedobiologia., 59(4), 215-223.
[https://doi.org/10.1016/j.pedobi.2016.04.001]

- Yang, S. K., Seo, Y. W., Lee, Y. S., Kim, H. W., Ma, K. C., Lim, K. H., Kim, H. J., Kim, J. G., Jung, W. J., 2011, Effects of green manure crops on red-pepper yields and soil physico-chemical properties in the vinyl house, Korean J. Soil. Sci. Fert., 19(2), 215-228.
-
Zhang, J., Ahmed, W., Zhou, X., Yao, B., He, Z., Qiu, Y., Wei, F., He, Y., Wei, L., Ji, G., 2022, Crop rotation with marigold promotes soil bacterial structure to assist in mitigating clubroot incidence in Chinese cabbage, Plants, 11, 2295.
[https://doi.org/10.3390/plants11172295]

-
Zhang, Y. S., Han, K. H., Jung, K. H., Cho, H. R., Seo, M. J., Sonn, Y. K., 2017, Study on the standards of proper effective rooting depth for upland crops, Korean J. Soil. Sci. Fert., 50(1), 21-30.
[https://doi.org/10.7745/KJSSF.2017.50.1.021]

-
Zhao, J., Yang, Y., Zhang, K., Jeong, J., Zeng, Z., Zang, H., 2020, Does crop rotation yield more in China? A meta-analysis, Field Crops. Res., 245, 107659.
[https://doi.org/10.1016/j.fcr.2019.107659]

National Institute of Crop sciencebgl1228@korea.kr
National Institute of Crop scienceleejt@korea.kr
National Institute of Crop scienceyangmink@korea.kr