해양 방선균 유래 물질의 정제 및 항균 활성
ⒸThe Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Antibiotics are substances produced by microorganisms that kill or inhibit and are essential for infectious diseases management. This study aimed to provide basic data for overcoming antibiotic resistance in the marine bacterium LJ-18. The API 20NE and API 50CH kits were used to identify this microorganism. Morphological, physiological, and biochemical properties were investigated using MacFaddin's manuals. Subsequently, isolated LJ-18 was found to belong to a genus of Streptomyces that forms mycelia. LJ-18 also grew well at 28-32°C on modified Bennett’s agar. To isolate and purify the antibacterial compound, LJ-18 culture was divided into ethyl acetate and distilled water fractions. Considerable antimicrobial activity against various pathogenic microorganisms, including methicillin-resistant Staphylococcus aureus (MRSA), was confirmed in the C18 ODS open column fractions. Peak 2 compound was obtained using reversed-phase HPLC. As a result, this compound had a significant antimicrobial activity against various pathogenic microorganisms. In particular, it showed strong activity against MRSA, Mycobacterium smegmatis, Bacillus subtilis, Bacillus cereus, and Staphylococcus aureus.
Keywords:
Antibacterial activity, Antibacterial compound, Marine Streptomyces, MRSA1. 서 론
항생제(antibiotics)는 미생물이 생산하는 물질로 다른 미생물의 생장을 억제하거나 사멸시키는 물질을 일컫는다. 그러나 항생제가 광범위하게 사용되면서 오·남용의 결과로 세균이 항생제 내성을 획득하게 되어 다제내성균이 출현하게 되었다. 이로써 오늘날 모든 국가의 중요한 건강 및 경제 문제로 대두되고 있다(Munita and Arias, 2016). 일례로 methicillin을 사용한 지 1년도 되지 않아 methicillin에 내성을 가지는 황색포도상구균(Staphylococcus aureus) 즉, MRSA (methicillin resistant Staphylococcus aureus)가 1961년 영국에서 발견되었고, 세계적으로 MRSA 감염률이 증가하게 되었다(Davis et al., 2007). 따라서 세계 보건 기구(WHO)는 새로운 항생제 개발이 필요한 병원체 목록에 MRSA를 기재 하였다(Cecchini et al., 2015). MRSA는 methicillin에만 내성을 보일 뿐만 아니라 모든 β-lactam 계 항생제에 다제내성을 가진다. 특히 면역력이 저하된 환자에게서 심내막염, 폐렴, 관절염, 골수염 및 뇌수막염 등의 중증 감염병을 일으키므로(Ha and Kim, 2003), 새로운 항생제의 개발과 발견이 중요한 시점이다.
대부분의 항생제는 미생물로부터 분리된 천연물질로서, 특히 Streptomyces 속과 Bacillus 속은 항생물질의 보고로 잘 알려져 있다. 오늘날 사용하는 항생제의 70%가 방선균에서 유래되었으므로, 방선균 유래 2차 대사물질은 신약 개발의 중요한 원천으로 여겨지고 있다(Jakubiec-Krzesniak et al., 2018). 특히 최근 연구 성과로 ceblantin (Moon et al., 2019) 및 boholamide A (Seo and Moon, 2021)등의 새로운 항생물질에 대한 보고가 활발히 이루어지고 있다. 따라서 다양한 질병에 치료 효과를 보이는 항균 물질을 생산하는 Streptomyces 속은 새로운 항생제 개발원으로서 그 가치가 매우 크다고 할 수 있다. 그러나 항생물질의 탐색은 대부분 토양 미생물을 대상으로 한 발견이 많으므로 다제내성균을 제어하기 위해서는 해양 미생물에서 새로운 구조와 메커니즘을 가지는 항생제의 개발이 절실하다. 이에 선진국들은 해양 미생물 유래 천연물을 집중적으로 연구하고 있다(Proksch et al., 2003). 완벽하게 탐험 되지 않은 해양 환경은 일반적으로 독특한 화학 구조를 가지는 방선균 또는 미생물을 보유할 가능성이 매우 큰 잠재적 자원이다(Jose and Jebakumar, 2014). 또한 1985년부터 2012년 사이 해양에서 분리된 생리 활성 물질 중 37%가 해양 미생물에서 발견되었고, 그중 47%는 해양 방선균 유래 2차 대사산물로, 해양 방선균은 생리활성물질 생산의 중요한 자원이다(Hu et al., 2015).
본 연구에서 분리한 Streptomyces sp. LJ-18 균주와 같은 속인 Streptomyces 속은 토양에 널리 분포하지만, 일부 해양에서 존재하기도 한다. 해양 방선균은 1984년에 처음 발견되었으며(Helmke and Weyland, 1984), 그 이후로 전 세계의 수중 환경에서 해양 방선균의 새로운 종들이 많이 발견되었다(Freel et al., 2012). 또한, 해양 방선균은 강력한 새로운 항생제 생산자로서 그 능력이 입증되고 있다(Manivasagan et al., 2014).
따라서 본 연구에서는 해양 방선균인 Streptomyces LJ-18 균주를 분리하여 그 형태와 생리적, 생화학적 특징을 조사하였다. 또한 이 균주가 생산하는 항균 물질을 분리하고, MRSA를 포함하여 다양한 병원 미생물에 대한 항균 활성을 측정함으로써, 새로운 항생제 개발을 위한 기초자료로 제시하고자 한다.
2. 재료 및 방법
2.1. 해양 방선균의 분리 및 표준 균주의 배양
MRSA를 포함하여 다양한 병원 미생물에 대하여 항균 활성을 가지는 해양 방선균을 분리하기 위해, 부산 조도 앞바다의 표층 해수를 멸균된 MB 채수기로 무균적으로 채수하였다. 이때 표층 해수의 온도는 25℃였다. 채수한 시료를 modified Bennett’s 배지(Jones, 1949)에 도말하여 24개의 해양 미생물 단일 집락을 분리하였고, 3차 획선을 통하여 순수분리를 확인한 후 냉장 보관하였다. 순수분리된 24개의 보관 균주들을 각각 100 mL의 modified Bennett’s 액체배지에 접종하여 25℃, 100 rpm으로 7일간 배양하였다. 배양 농축액들을 disc agar diffusion assay (National committee for Clinical Laboratory Standards; NCCLS, 2009)법으로 항균 활성을 측정하였다. 균주들의 배양 농축액 중 항균 활성이 높은 균주를 우선 선별하였다.
LJ-18의 MRSA 및 병원 미생물에 대한 항균 활성을 알아보기 위해 사용된 표준 균주는 동아대학교 병원에서 임상 분리한 MRSA인 DA 8과 DA 16의 2개 균주와 KCTC (Korean Collection for Type Cultures)에서 분양받은 Mycobacterium smegmatis 및 CCARM (Cultures Collection Of Antimicrobial Resistant Microbes)에서 분양받은 Bacillus subtilis, Bacillus cereus, Escherichia coli, Enterococcus faecalis, Staphylococcus aureus (2개 균주), Klebsiella pneumoniae, Pseudomonas aeruginosa의 8개 균주를 본 실험에 사용하였다(Table 1). 이러한 표준 균주들은 NB (nutrient broth) 배지에서 25-30℃ 조건으로 배양하였다.
2.2. 우수 균주의 선별 및 동정
상기 실험의 결과, MRSA를 포함하는 다양한 병원 미생물에 대하여 가장 높은 항균 활성을 보인 LJ-18 균주를 선별하고 이후 실험을 진행하였다. 선별 균주의 동정을 위한 실험 방법은 다음과 같다. 배양적 특징과 탄소 이용능은 ISP (International Streptomyces Project) media (Shirling and Gottlieb, 1966)에 배양하며 관찰하였다. 기본적인 실험 방법과 생리 및 생화학적 특징들은 biochemical tests for identification of medical bacteria (MacFaddin, 1980)의 방법을 따랐다. 또한 API 20NE와 API 50CH kit (Bio merieux Co.,, France)에 배양하여 그 결과를 apiweb™ database에 입력하여 속(genus) 수준까지 동정하였다.
2.3. 선별 균주의 수층 분획물의 항균 활성 측정
순수분리 후 냉장 보관되어 있던 LJ-18 균주를 modified Bennett’s 고체배지에 streaking 한 후 single colony를 확인하고, 이를 100 mL의 modified Bennett’s 액체배지에 접종하여 30℃, 100 rpm으로 7일간 전 배양하였다. 이후 전 배양액 100 mL를 modified Bennett’s 액체배지 10 L에 재접종하여(10 L x 3) 30℃, 100 rpm으로 7일간 배양하였다. 이 배양액을 ethyl acetate (Duksan, Korea)와 1:1로 혼합하여 교반기(DAIHAN scientific)로 혼합해준 후, separate funnel에 넣고 이층분배를 3회 실시하였다. 항균 활성이 확인된 수층 (distilled water)을 분획하여 2차로 butanol (Duksan, Korea)과 1:1로 혼합하여 이층분배 하였다. 2차 항균 활성이 확인된 수층 물을 rotary evaporator (EYELA, Japan)로 감압 농축하여 수층 분획물을 획득하였다.
수층 분획물을 증류수에 녹인 후, disc agar diffusion 방법에 따라 항균 활성을 측정하였다. 즉 MRSA를 포함한 병원 미생물들을 NA (nutrient agar) 배지에 100 ㎕씩 분주하여 도말 한 뒤, 6 mm paper disc (ADVANTEC, Japan)를 올려놓고 D.W. 분획물을 4 ㎕ (400 ㎍/disc)씩 loading 하였다. Clean bench에서 paper disc를 5-10분 건조 시키고, 25℃에서 48시간 배양한 후 paper disc의 주위에 형성된 성장 저해환(zone of inhibition)의 직경을 측정하였다.
2.4. 항균 활성 물질의 순수분리 및 활성 측정
항균 활성을 나타내는 수층 분획물을 C18 ODS open column (DAISO, Japan)으로 분획하였다. 이때, 접종할 시료인 추출물의 무게를 측정하여 column의 높이를 설정하였다: 원기둥 부피(πr2h) = 시료 무게 (g) × 140. 이동상으로는 증류수, 20%, 40%, 60%, 80% 및 100% 메탄올과 dichloromethane을 사용하였다. 각각의 이동상으로부터 분획한 fraction 들을 감압 농축하여 무게를 재고 항균 활성을 측정하였다. 가장 높은 항균 활성을 보인 60%와 80% MeOH 분획을 혼합하여 역상 HPLC (정지상: YMC-PACK SIL, 250 x 10 mm, S-5 ㎛, 12 nm, 이동상: A: 80% MeOH, B: D.W.)를 시행하였다. 이때 이동상은 30분간 2.0 mL/min의 유속으로 흘려주었고, 시료의 양은 30 ㎕씩 주입하였으며, 210 nm UV 파장에서 측정하였다(Table 2). 그 결과로 얻은 최종 순수물질 HPLC peak 2 물질을 25 ㎍/disc 농도부터 2-fold serial dilution하여 표준 균주들에 대한 항균 활성을 측정하였다.
3. 결과 및 고찰
3.1. 우수 균주의 선별 및 동정
본 실험에서는 부산 조도 앞바다의 표층 해수에서 채수한 해수를 modified Bennett’s 평판배지에 도말하여, 24개의 해양 미생물을 순수분리하였다. 이 균주들을 MRSA를 포함하는 9개의 병원 미생물에 대해 항균 활성을 검정하였다. 즉, 우수 균주를 선별하는 예비 실험으로써, 24개의 균주들을 modified Bennett’s 액체배지에 배양하여, 배양 농축액들의 활성을 측정하였다. 가장 높은 항균 활성을 보인 균주를 LJ-18이라고 명명하였고, 실험 결과는 Table 3에 나타내었다. LJ-18 균주의 배양 농축액은 400 ㎍/disc의 농도에서 DA 16 (MRSA) 균주에 20 mm의 저해환을, Staphylococcus aureus CCARM 3200와 Bacillus cereus CCARM 0002에 각각 10 mm의 저해환을 형성하였다. 이러한 결과는 (Park et al., 2013)이 보고한 Bacillus subtilis MP56의 활성보다 10배 이상 높은 활성이었다.
Antibacterial activity of culture concentrate of Streptomyces sp. LJ-18 against pathogenic bacteria. Concentration: 400 ㎍/disc
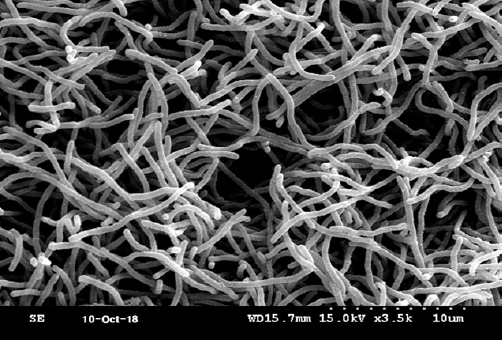
LJ-18 균주의 동정을 위하여 배양적, 형태적, 생리 및 생화학적 특성들을 조사한 결과는 Table 4와 5에 나타내었다. 본 균주는 그람 양성 간균으로 전자현미경 사진은 Fig. 1과 같다. 또한 실 모양의 균사체를 형성하였고, 균사체의 표면은 매끈하고 나선형 구조를 이루고 있었다(Fig. 1). Modified Bennett’s agar 배지에서 잘 자라며 보라색의 콜로니를 형성하였다(Table 4). Streptomyces 속의 콜로니의 색은 균사와 포자의 색에 따라 다양한데, 이러한 특징은 한천 배지 상에서 Streptomyces의 구분을 용이하게 한다. 특히 1966년 국제적으로 제안된 ISP (International Streptomyces Project) 방법이 많이 이용되고 있는데, ISP 배지 상에서 자라는 LJ-18 균주의 배양학적 특징을 Table 4에 정리하였다. 세포벽에는 아미노산의 한 종류인 DAP (Diaminopimelic acid)를 LL 형태로 가지고 있었으며, 최적 성장 온도는 28-32°C, 최적 pH는 8.2, 최적 NaCl 농도는 3.2%였다. 또한 pH 6.0에서 9.0까지의 비교적 넓은 범위의 pH 조건에서도 잘 성장하였으며, 5.0%까지의 NaCl 농도에서도 성장할 수 있었지만, 15℃ 이하에서는 자라지 못하였다(Table 5). 이상의 결과 본 균주는 해양 환경에 잘 적응한 방선균 또는 해양 유래 방선균으로 판단된다. 또한 LJ-18 균주는 H2S 생성능 젤라틴 액화능, 전분 가수분해능 및 질산염 환원능이 있었으나, 카제인 분해능은 없었다. 탄소 이용능을 확인한 결과, D-Glucose, D-Xylose, D-Maltose, D-Sucrose, D-Galactose, N-acetyl-D-galactosamine에 양성이었다(Table 5). LJ-18 균주는 전형적인 방선균의 형태적, 생리 및 생화학적 특성들을 보였으며, apiweb™ database에 입력하여 1차적으로 분류학적 유사성을 검토한 결과 Streptomyces 속으로 확인되어, 본 균주를 Streptomyces sp. LJ-18로 명명하였다.
3.2. LJ-18의 수층 분획물의 항균 활성 측정
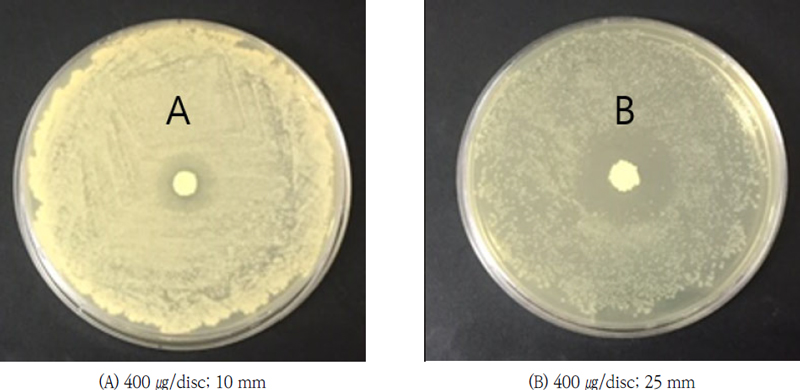
LJ-18 균주 배양액을 ethyl acetate와 butanol로 이층분배 하여 얻은 수층 분획물에서 항균 활성이 나타났으며, 그 결과는 다음과 같다(Fig. 2, 3). 수층 분획물은 400 ㎍/disc의 농도에서 Staphylococcus aureus CCARM 3200에 대해 25 mm의 저해환을 보였다. 이러한 결과는 같은 농도에서 실험한 LJ-18 균주의 배양 농축액이 10 mm의 저해환을 보인 것과 비교해 볼 때 활성이 증가했음을 보여준다. 그러나 D.W. 분획물은 Staphylococcus aureus CCARM 3200과 Bacillus cereus CCARM 0002 및 Escherichia coli CCARM 0230에 대해서 활성이 증가하지 않았으나, 이후 진행된 정제 과정에서 활성이 증가하였다.
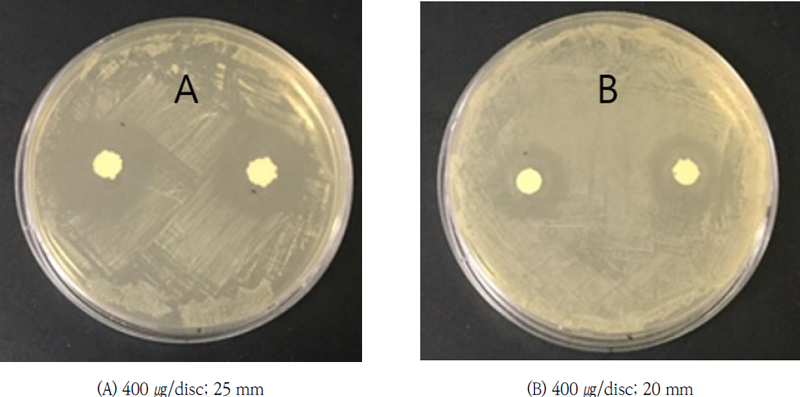
Antibacterial activity of D.W. fraction of Streptomyces sp. LJ-18 against (A) Staphylococcuss aureus CCARM 3200 and (B) DA 16.
3.3. LJ-18이 생산하는 항균 물질의 정제 및 순수분리
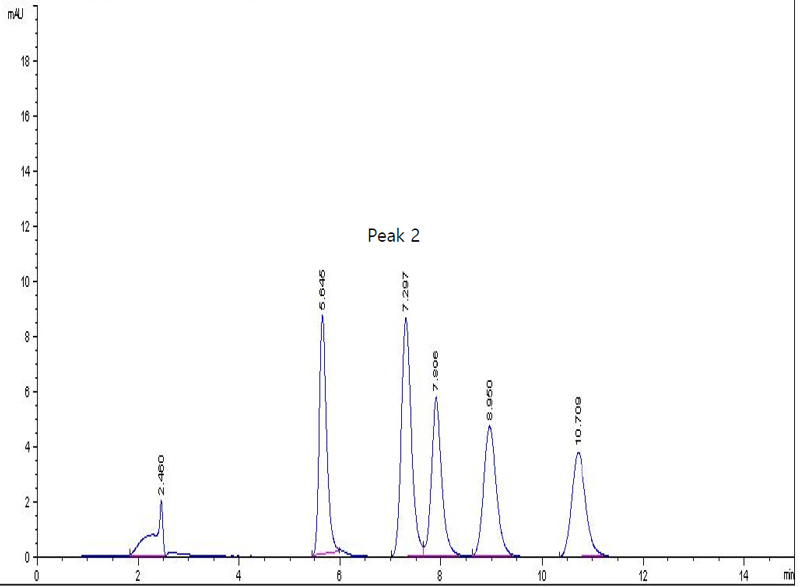
항균 활성을 보인 수층 분획물을 C18 ODS open column (DAISO, Japan)으로 크로마토그래피를 행하여, 총 7개의 분획(증류수, 20%, 40%, 60%, 80%, 100% MeOH, dichloromethane)을 얻었고, 회수한 액체를 감압 농축하여 항균 활성을 측정한 결과, 60%와 80% MeOH 분획물에서 높은 항균 활성을 확인하였다. 이 2개의 분획물을 혼합하여 80% MeOH을 이동상으로 하여 역상 HPLC를 실시하였다. 그 결과 5개의 HPLC peak 물질을 얻었으며, 그중 peak 2 물질에서 우수한 항균 활성이 나타났다. Peak 2 물질이 순수물질임을 재차 HPLC를 행하여 확인하였으며, 이때 머무름 시간(retention time)은 7.297 min이었다(Fig. 4).
3.4. 최종 정제 순수물질의 항균 활성 측정
Streptomyces sp. LJ-18 배양액에서 분리한 최종 순수물질 HPLC peak 2 물질을 25 ㎍/disc 농도부터 2-fold serial dilution 하여 항균 활성을 측정한 결과는 다음과 같다(Table 6, Fig. 5-8). Klebsiella pneumoniae CCARM 0015를 제외하고, 본 실험에 이용한 대부분의 병원 미생물들에 대해서 25 ㎍/disc 농도에서도 저해환 35 mm 이상의 매우 높은 항균 활성을 보였다. 또한 대부분의 균주들에서 25 ㎍/disc 농도보다 3.125 ㎍/disc 농도에서 활성이 증가하는 좋은 결과를 보여주었다. 특히 DA 8 (MRSA), DA 16 (MRSA), Mycobacterium smegmatis KCTC 2002, Bacillus subtilis CCARM 0003, Bacillus cereus CCARM 0002 및 Staphylococcus aureus CCARM 3089 (MRSA) 균주에 대해서, 3.125 ㎍/disc에서 25 mm 이상의 매우 높은 항균 활성을 보였다. 한편 DA 8 (MRSA) 균주에 대해서는 25 ㎍/disc 농도와 3.125 ㎍/disc 농도에서의 저해환의 크기가 둘 다 35 mm의 저해환을 형성하여 측정값이 같은 것으로 측정되는데, 이것은 저해환의 크기가 너무 커서 측정 불가한 것으로, 더 낮은 농도에서 실험하면 더 좋은 활성이 나올 것으로 보인다. 한편 (Bang et al., 2011)은 Streptomyces sp. BCNU 1030이 0.78 ㎍/disc 농도에서 MRSA CCARM 3089, CCARM 3090, CCARM 3091 및 CCARM 3095에 대해 각각 14 mm, 16 mm, 16 mm 및 18 mm의 우수한 clear zone를 보였다고 보고한 바 있다.
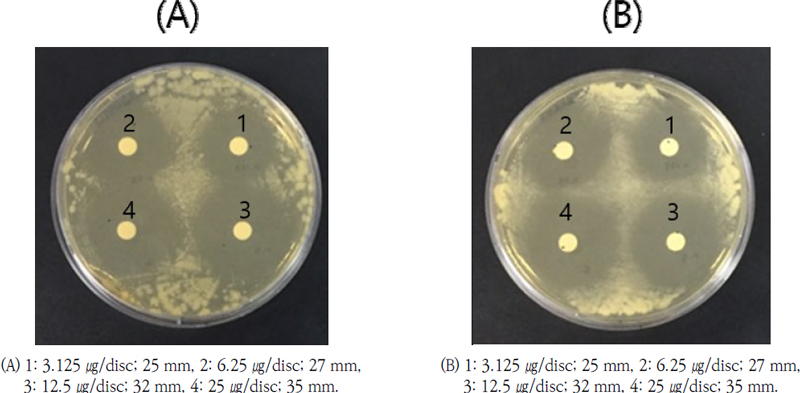
Antibacterial activity of HPLC peak 2 compound against (A) Mycobacterium smegmatis KCTC 2002 and (B) Bacillus cereus CCARM 0002.
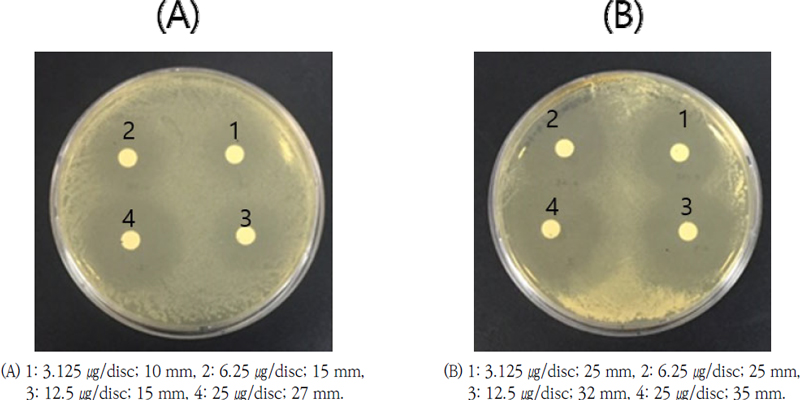
Antibacterial activity of HPLC peak 2 compound against (A) Klebsiella pneumoniae CCARM 0015 and (B) Staphylococcus aureus CCARM 3089.
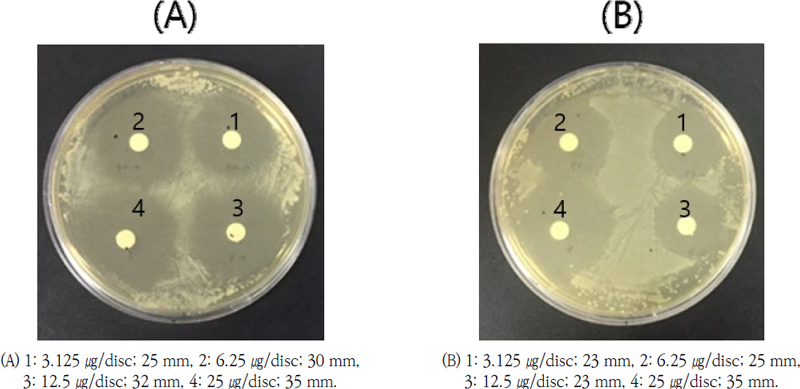
Antibacterial activity of HPLC peak 2 compound against (A) Bacillus subtilis CCARM 0003 and (B) Pseudomonas aeruginosa CCARM 0219.
본 물질은 병원성인 Enterococcus faecalis CCARM 0029와 Staphylococcus aureus CCARM 3200 (MRSA)에 대해서는 항균 활성을 보이지 않았다. 실험에 사용한 MRSA 균주인 DA 8, DA 16 및 Staphylococcus aureus CCARM 3089에 대해서 높은 활성을 보인 것과 비교해본다면, 같은 MRSA라도 균주에 따라 항균 활성이 다르다는 것을 시사한다. 한편 일반적으로 항생제는 그람 음성균보다 그람 양성균에 대해 높은 활성을 보이는데, 본 실험에서 분리한 HPLC peak 2 물질에서는 유의한 차이점이 보이지 않았다. 이상의 결과, 본 실험에서 분리한 물질은 MRSA를 포함하여 다양한 그람 양성 및 그람 음성균의 병원 미생물에 대하여 높은 항균 활성을 보여주었다. 향후 본 실험에서 분리한 물질이 항생제로서 개발되기 위해서는 비병원성 미생물에 대한 영향을 조사할 필요가 있을 것이다.
4. 결 론
항생제는 1928년 Fleming에 의해 발견된 penicillin을 시초로 오늘날까지 의약품으로 사용되고 있다. 그러나 항생제 오남용의 결과로 다제내성균이 출현하게 되었고, 이를 치료할 수 있는 치료제 개발을 위해 알려지지 않은 다양한 생리활성물질이 존재하는 해양 미생물로부터 새로운 항생제를 개발하려는 많은 시도가 이루어지고 있다. 본 연구에서는 부산 조도 앞바다에서 채수한 해수로부터 MRSA 및 다양한 병원 미생물에 대해 항균 활성을 가지는 해양 방선균 Streptomyces sp. LJ-18 균주를 분리, 동정하고 배양적, 생리학적, 생화학적 특성을 조사하였다. 또한 이 균주의 배양액을 ethly acetate와 부탄올로 이층분배하고, 항균 활성이 있는 수층을 C18 ODS open column으로 정제하였다. 정제해낸 분획물 중 항균 활성이 높은 60%와 80% MeOH 층을 혼합하여 역상 HPLC를 행하였다. 그 결과 항균 활성이 가장 높은 최종 순수물질인 HPLC peak 2 물질을 분리하였다. Peak 2 물질은 3.125 ㎍/disc 농도에서 MRSA를 포함하여 대부분의 병원성 균주들(DA 8 (MRSA)과 DA 16 (MRSA), Mycobacterium smegmatis KCTC 2002, Bacillus subtilis CCARM 0003, Bacillus cereus CCARM 0002 및 Staphylococcus aureus CCARM 3089 (MRSA))에 대해 저해환 25 mm 이상의 매우 높은 항균 활성을 나타내었다. 또한 본 물질은 MRSA를 포함하여 다양한 그람 양성 및 그람 음성균의 병원 미생물에 대하여 높은 항균 활성을 보여주었다.
본 연구에서 분리, 정제한 물질은 항 MRSA 활성을 포함하여 다양한 병원 미생물에 대해 항균 활성이 매우 높았으므로, 향후 그 화학적 특성과 구조를 규명하고 작용기작을 밝혀낸다면 새로운 항생제로서의 잠재적 가능성이 매우 크다고 판단된다.
Acknowledgments
이 논문은 2021년도 대구가톨릭대학교 학술연구비 지원에 의한 것이며 이에 감사드립니다(20211191).
References
-
Bang, J. H., Choi, H. J., Ahn, C. S., Kim, D. W., Jeong, Y. K., Joo, W. H., 2011, In vitro antimicrobial activity of a new isolate Streptomyces sp. BCNU 1030, J. Life Sci., 21(4), 589-595.
[https://doi.org/10.5352/JLS.2011.21.4.589]

- Cecchini, M., Langer, J., Slawomirski, L., 2015, Antimicrobial resistance in G7 countries and beyond: economic issues, policies and options for action, Organization for Economic Co-operation and Development (OECD), Paris, France.
-
Davis, S. L., Perri, M. B., Donabedian, S. M., Manierski, C., Robinson-Dunn, S., Hayden, M. K., Zervos, M. J., 2007, Epidemiology and outcomes of community-associated methicillin-resistant Staphylococcus aureus infection, J. Clin. Microbiol., 45, 1705-1711.
[https://doi.org/10.1128/JCM.02311-06]

-
Freel, K. C., Edlund, A., Jensen, P. R., 2012, Microdiversity and evidence for high dispersal rates in the marine Actinomycete “Salinispora Pacifica”, Environ. Microbiol., 14, 480-493.
[https://doi.org/10.1111/j.1462-2920.2011.02641.x]

-
Ha, D. J., Kim, Y. J., 2003, Management of infection for methicillin resistant Staphylococcus aureus at an orthopaedic surgery department, J. Kor. Orthop., 38, 34-38.
[https://doi.org/10.4055/jkoa.2003.38.1.34]

-
Helmke, E., Weyland, H., 1984, Rhodococcus Marinonascens, Int. J. Syst. Bacteriol., 34, 127-138.
[https://doi.org/10.1099/00207713-34-2-127]

-
Hu, Y., Chen, J., Hu, G., Yu, J., Zhu, X., Lin, Y., Chen, S., Yuan, J., 2015, Statistical research on the bioactivity of new marine natural products discovered during the 28 years from 1985 to 2012, Mar. Drugs, 13, 202-221.
[https://doi.org/10.3390/md13010202]

-
Jakubiec-Krzesniak, K., Rajnisz-Mateusiak, A., Guspiel, A., Ziemska, J., Solecka, J., 2018, Secondary metabolites ofactinomycetes and their antibacterial, antifungal and antiviral properties, Pol. J. Microbiol., 67, 259-272.
[https://doi.org/10.21307/pjm-2018-048]

-
Jones, K. L., 1949, Fresh isolates of actinomycetes in which the presence of sporogenous aerial mycelia is a fluctuating characteristic, J. Bacteriol., 57(2), 141.
[https://doi.org/10.1128/jb.57.2.141-145.1949]

-
Jose, P. A. Jebakumar, R. S. D., 2014, Unexplored hypersaline habitats are sources of novel actinomycetes, Front Microbiol., 5, 242.
[https://doi.org/10.3389/fmicb.2014.00242]

- MacFaddin, J. F., 1980, Biochemical tests for identification of medical bacteria, 2nd ed., The Williams and Wilkins Co., Baltimore, USA.
-
Manivasagan, P., Venkatesan, J., Sivakumar, K., Kim, S. K., 2014, Pharmaceutically active secondary metabolites of marine Actinobacteria, Microbiol. Res., 169, 262-278.
[https://doi.org/10.1016/j.micres.2013.07.014]

-
Moon, K., Xu, F., Seyedsayamdost, M. R., 2019, Ceblantin, a cryptic lanthipeptide antibiotic uncovered using bioactivity-coupled HiTES, Angew. Chem. Int. Ed. Engl., 58, 5973-5977.
[https://doi.org/10.1002/anie.201901342]

-
Munita, J. M., Arias, C. A., 2016, Mechanisms of antibiotic resistance, Microbiol. Spectrum, 4(2), 10.1128 /microbiolspec, VMBF-0016-2015.
[https://doi.org/10.1128/microbiolspec.VMBF-0016-2015]

- National Committee for Clinical Laboratory Standards, 2009, Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard M07-A8, 8th ed., National Committee for Clinical Laboratory Standards, Wayne, PA, USA.
-
Park, S. G., Yoo, J. C., Seong, C. N., Cho, S. S., 2013, Isolation and characterization of Bacillus subtilis MP56 with antimicrobial activity against MDR (multi drug resistant) strains, Kor. J. Microbiol., 49(1), 90-94.
[https://doi.org/10.7845/kjm.2013.017]

-
Proksch, P., Edrada, R. A., Ebel, R., 2003, Drugs from the sea- opportunities and obstacles, Mar. Drugs, 1, 5-17.
[https://doi.org/10.3390/md101005]

- Seo, J., Moon, K., 2021, Structure and bioactivity of boholamide A from a tidal mudflat actinomycete, Kor. J. Pharmacogn., 52, 203-207.
-
Shirling, E. B., Gottlieb, D., 1966, Methods for characterization of Streptomyces species, Int. J. Syst. Bacteriol., 16(3), 313–340.
[https://doi.org/10.1099/00207713-16-3-313]

Department of Biomedical, Daegu Catholic Universityjsymicro@cu.ac.kr