
곤충변태호르몬 엑디손의 멜라토닌수용체 증진을 활용한 파킨슨 수면장애 개선 효과
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Parkinson’s disease (PD) is a neurodegenerative disorder characterized by motor symptoms such as bradykinesia, rigidity, tremors, and postural instability, primarily caused by the degeneration of dopaminergic neurons in the substantia nigra. While current treatments focus on managing motor symptoms, non-motor symptoms, including sleep disturbances, are increasingly being recognized as significant contributors to reduced quality of life in patients with PD. Melatonin, a key hormone in regulating circadian rhythms, is often dysregulated in PD, exacerbating insomnia and other sleep disorders. This study investigated the potential role of 20-hydroxyecdysone, an insect-molting hormone, in alleviating sleep disturbances associated with PD. Using STRING database analysis , we identified 12 melatonin-related genes, and confirmed significant downregulation of Mtnr1a in the hypothalamus of 1-Methyl-4-(2′-methylphenyl)-1,2,3,6-tetrahydropyridine hydrochloride-induced PD mouse models. Functional assays demonstrated that 20-hydroxyecdysones enhanced melatonin receptor binding affinity (IC₅₀: 5.29 μM) and improved sleep onset and duration in alfaxan-induced sleep tests. Furthermore, the expression of the cellular oncogene fos, a biomarker for neuronal activation, was significantly elevated in the ventrolateral preoptic nucleus, suggesting 20-hydroxyecdysone’s role in activating sleep-regulating neural circuits. These findings highlight the therapeutic potential of 20-hydroxyecdysone in improving PD-related sleep disturbances by modulating melatonin receptor activity, and warrant further investigation into its molecular mechanisms.
Keywords:
20-hydroxyecdysone, Melatonin, Sleep disturbances, Cellular oncogene fos, Parkinson’s disease1. 서 론
파킨슨병(Parkinson’s disease, PD)은 운동완만, 근경직 증가, 진전, 자세불안정 등과 같은 운동성 장애증상을 보이는 신경계 퇴행성 질환이다(Stocchi et al. 2024). 이는 중뇌 흑질부위의 도파민성 신경세포의 소실로 인한 신경질환으로 환경적 인자, 노화, 산화스트레스 등을 병인으로 보고 있다(Stocchi et al. 2024). 때문에 현재까지 수많은 파킨슨병의 진단과 치료방법은 운동증상을 중심으로 발전해왔다. 그러나 최근 비운동성 파킨슨병의 중요성이 강조되고 있으며, 파킨슨병 환자의 대부분이 비운동증상을 경험하고 있다고 보고 되고 있다(Stocchi et al., 2024; Baumgartner et al., 2025). 대표적인 파킨슨병 비운동증상에는 인지기능이상, 기분장애, 통증, 후각기능장애 및 수면장애 등이 있다(Stocchi et al. 2024; Suzuki et al., 2025). 그 중 많은 관심을 받고 있는 증상이 바로 수면장애이다. 특히 불면증, 수면발작, 하지불안증후군, 렘수면행동장애 등이 연관지어 연구가 진행되고 있으며, 수면장애의 원인은 명확하게 밝혀져 있지 않으나, 병 자체에 의한 중간뇌껍질변연계(Mesolimbic pathway) 도파민 회로의 변화 또는 수면-각성 과정의 영향 등 여러 요소가 작용할 것으로 생각된다(Stocchi et al. 2024; Baumgartner et al., 2025; Suzuki et al., 2025).
멜라토닌은 수면-각성 주기를 조절하는 데 중요한 역할을 하며, 주로 야간에 분비가 증가하여 생체리듬의 유지에 기여한다(Galvani et al., 2025). 그러나 파킨슨병 환자에서는 멜라토닌 분비의 불규칙성과 함께 수면장애, 특히 불면증이 흔히 나타난다(Galvani et al., 2025). 이는 뇌의 시상하부와 관련된 신경세포의 퇴행 및 기능 저하와 밀접한 관련이 있다. 시상하부 내 수면 조절의 핵심 역할을 하는 복외측시각교차전핵(Ventrolateral preoptic nucleus, VLPO)는 수면 유도와 유지를 담당하지만, 파킨슨병 환자에서는 이 영역의 기능 이상이 관찰된다(Wang et al., 2020; Galvani et al., 2025). 더불어, 파킨슨병에서 나타나는 도파민 신경 경로의 이상은 멜라토닌 신호 전달 체계에도 영향을 미쳐 불면증 증상을 악화시키는 것으로 보고되고 있다(Wang et al., 2020; Galvani et al., 2025). 이러한 메커니즘을 활용한 연구는 파킨슨병 환자의 수면장애 개선을 위한 치료법 개발에 중요한 단서를 제공하고 있다.
20-Hydroxyecdysone (20E)는 곤충의 주요 탈피 호르몬인 엑디손의 스테로이드 호르몬 전구물질로, 곤충뿐만 아니라 일부 식물에서도 발견된다(Lim et al., 2020). 최근 20E는 근력 및 근육량 증가, 피로 감소, 회복 촉진 등의 이유로 운동선수들 사이에서 다이어트 보충제로 널리 사용되고 있다(Lim et al., 2020). 뿐만 아니라, 근육 단백질 합성 촉진, 탄수화물과 지방 대사 조절, 뼈 형성, 에너지 대사, 세포자살 억제, 줄기세포 분화 유도 등 다양한 약리적 특성을 가진 것으로 보고되었다(Lim et al., 2020; Shuvalov et al., 2024; Li et al., 2025). 본 연구진은 엑디손이 파킨슨병 운동장애 개선에 탁월한 효과를 나타냄을 확인하였으며, 이는 산화스트레스 대응 유전자(Transcription factor nuclear factor erythroid 2-related factor 2, heme oxygenase-1, and NAD(P)H-quinone oxidoreductase 1)의 활성화를 통해 도파민성 신경세포를 보호하고 항산화효소 생성을 촉진하는 기전으로 설명된다(Lim et al., 2020). 그러나 엑디손과 수면 간의 연관성에 대한 연구는 보고된 바가 없으며, 이에 본 연구에서는 세포 수준의 유전자 스크리닝을 통해 엑디손의 새로운 생리적 작용과 수면과의 연관성 발견하여 이를 동물실험으로 확인연구를 수행하여 파킨슨병 비운동성 행동장애 중 수면장애 개선에 대한 유효성을 확보하고자 한다.
2. 재료 및 방법
2.1. 사육과 투여
C57BL/6 생쥐 8 주령을 두열바이오텍(Seoul, Korea)을 통해 구입하였으며, 물과 사료는 자유롭게 섭취하도록 하였고, 온도(22 ± 2℃), 습도(53 ± 3%) 및 명암 주기(12 시간)는 자동적으로 조절되도록 하였다. 본 실험은 한국한의학연구원 동물실험 윤리위원회의 승인을 받아 진행하였다. 제1군(대조군, n=5) 및 제2군(MPTP군, n=5)은 식염수를 5 일간 1일 1회 경구 투여하였고, 제3(엑디손 및 MPTP 투여군, n=5)은 10 mg/kg으로 5일간 1일 1 회 경구 투여하였다. 본 연구에서는 MPTP acute 모델을 사용하였으며, 투여 3일차가 되는 날 제1군은 생리식염수를 생쥐 체중 kg당 5 mL로 2 시간 간격으로 4회 복강 내 투여하였으며, 나머지 군은 MPTP를 20 mg/kg 체중의 농도로 생리식염수 5 mL에 용해시켜 2시간 간격으로 4회 복강 내 투여하였다.
2.2. Alfaxan 유도 수면시험
MPTP 투여 후 5일차 마우스에 Alfaxan을 복강투여한 후 정좌반사(Righting reflex)를 기준으로 수면 유도시간(Sleeponset time)과 수면 지속시간(Sleep duration time)을 측정하였다. 기준이 되는 정좌반사는 실험동물을 뒤집었을 때 자세를 바르게 하는 행동을 뜻한다.
2.3. 전사체 발현 분석
우리는 멜라토닌 수용체와 관련된 전사체 분석을 위해 STRING 데이터베이스에서 멜라토닌과 관련된 Mtnr1a와 Mtnr1b를 기준으로 상관관계를 보이고 있는 10종의 유전자를 DAVID 및 Medline 데이터베이스에서 검색한 결과를 기반으로 도출했다. 이후 파킨슨병 동물 모델의 시상하부 부위의 quentSeq3’mRNA-Seq 전사체(Ebiogen Inc, Seoul, Korea) 분석에서 Mtnr1a와 Mtnr1b포함 12종의 유전자의 발현정도를 분류하여 분석하였다.
2.4. CHO-MT1 세포 제작 및 방사성 리간드 결합력 분석
이는 이전 발표된 연구를 기반으로 프랑스 ㈜Eurofins 사의 Annie OTTO-BRUC 박사에 의해 연구(Report ID: FR095-0009279 with Komabiotech®)되었으며, 이를 간략히 하였다(Browning et al., 2009). 인간 MT1 수용체 클론은 Xenopus laevis의 멜라토닌 수용체 염기서열에 기초한 Degenerate primers로 증폭하였으며, 클로닝은 pBluescript (Stratagene) 벡터를 사용하여 수행되었다. 이후 Calcium phosphate precipitation 방법으로 Chinese hamster ovary cells (CHO) 세포에 transfection 하였고, G418에 저항성을 가진 MT1 세포주 중 [3H]-멜라토닌 결합 및 Cyclic AMP accumulation 억제 효과를 기준으로 최적의 세포주를 선정하였다. Radioligand binding assays은 96-웰 플레이트에서 500 μl의 반응 부피로 수행되었으며, [3H]-멜라토닌 (10 nM)을 엑디손 (0.001~10 μM)과 함께 37°C에서 120분 동안 배양하였다. 배양에 사용된 완충 용액은 50 mM Tris-HCl, 2 mM MgCl₂, 1 mM EDTA, 0.1% 아스코르빈산 (pH 7.4)로 구성되었다. 단백질 농도에서 첨가된 방사성 리간드의 10% 미만이 결합되었으며, 비특이적 결합은 1 μM 멜라토닌으로 정의하였다. 결합 실험은 [3H]-멜라토닌(10 nM)을 막 단백질(0.001~10 μM)과 180분 동안 배양하였고, 해리 실험은 2시간 배양 후 1 μM 멜라토닌으로 해리를 유도하여 0~240분 간 샘플을 채취해 분석하였다. 결합된 방사성 리간드는 GF/B 필터지를 이용한 빠른 여과법으로 분리하였고, 필터지는 50 mM Tris-HCl (pH 7.4) 용액으로 4회 세척한 후, 방사능은 액체 섬광 분광법으로 정량하였다.
2.5. 면역염색법
고정 후 30 μM로 절단된 뇌조직의 시상하부 부분을 골라 PBS워싱 후, H2O2를 10분간 처리하였다. 그 후 Rabbit-anti-c-fos, secondry-anti-rabbit body, ABC solution를 차례로 반응시켰으며, 이후 3,3'-Diaminobenzidine tetrahydrochloride salt로 발색시켰다. 이 후 탈수 과정을 거쳐 Vectashield mounting medium으로 커버슬라이드로 덮어 보관하였다. 또한, Microscope (Olympus Microscope System BX53; Olympus, Tokyo, Japan)를 사용하여 사진을 촬영하였다.
2.6. 통계처리
p모든 측정값은 Mean ± S.E.M으로 표시하였다. 본 연구의 통계처리는 Graphpad Prism 5.0 (San Diego, CA) 프로그램을 사용하였으며, One-way ANOVA를 이용하였으며, 사후검정은 Tukey test를 이용하여 평균값의 유의성을 5% 미만의 한계로 조사하였다.
3. 결과 및 고찰
3.1. 파킨슨병 동물모델을 활용한 멜라토닌 연관 유전자 도출
본 연구진은 STRING 데이터베이스를 통해 멜라토닌과 연관되어 있는 유전자를 선별하였다. 그 결과 Mtnr1a, Mtnr1b, Gpr55, Aanat, Oxgr1, Gabrr3, Sucnr1, Gng10, Gng8, Gm5741, Gpr50, Asmt로 선별되었으며(Fig. 1A) MPTP로 유발된 마우스의 VLPO의 mRNA-seq로 교차 분석한 결과 150%이상 증가된 유전자는 Oxgr1로 나타났다(Fig. 1B). 50%이상 감소된 유전자는 Gpr50, Gm5741, Aanat, Mtnr1a로 나타난 것을 확인하였다(Fig. 1B).
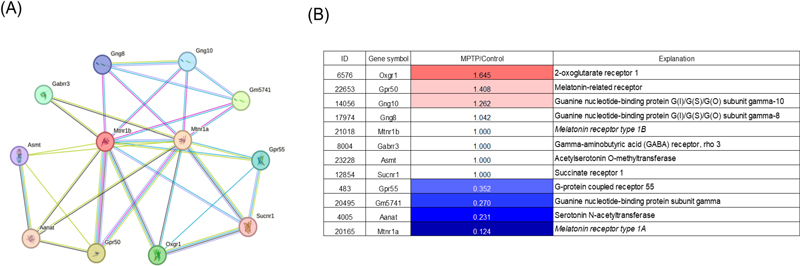
Analysis of 12 genes interacting with melatonin receptors using STRING database and gene expression in the brains of MPTP-induced Parkinson's disease animal model. (A) Using the STRING database, interactions between melatonin receptors (Mtnr1a, Mtnr1b) and associated signaling pathways were analyzed, resulting in the classification of 10 genes. Nodes represent proteins, and edges indicate interactions based on experimental data, co-expression, and database annotations. Node colors reflect functional clusters.(B) Gene expression analysis of identified genes in the brains of MPTP-induced Parkinson's disease animal models. Genes with increased expression are shown in red shades, while those with decreased expression are shown in blue shades. Genes with no significant change in expression (fold change = 1) are displayed in neutral colors. Significant downregulation was observed in Gpr55, Gnas741, Anat, and Mtnr1a, while Oxgr1 showed notable upregulation.
3.2. [3H]-멜라토닌 결합을 통한 MT1 수용체의 약리학적 특성 분석
다음으로 엑디손의 멜라토닌 수용체와의 반응성을 확인하기 위해 [3H]-멜라토닌과의 결합하는 MT1 수용체에 대한 작용증진력을 측정하였다. 그 결과 엑디손은 5.29 μM에서 50%의 Agonisim 값을 보였으며(Fig. 2), 이는 Fig. 1에서의 MPTP 신경독성으로 유발된 파킨슨병 모델에 적용 시 멜라토닌의 수용체를 향상시켜 수면장애를 해소할 수 있는 가능성을 보였다.
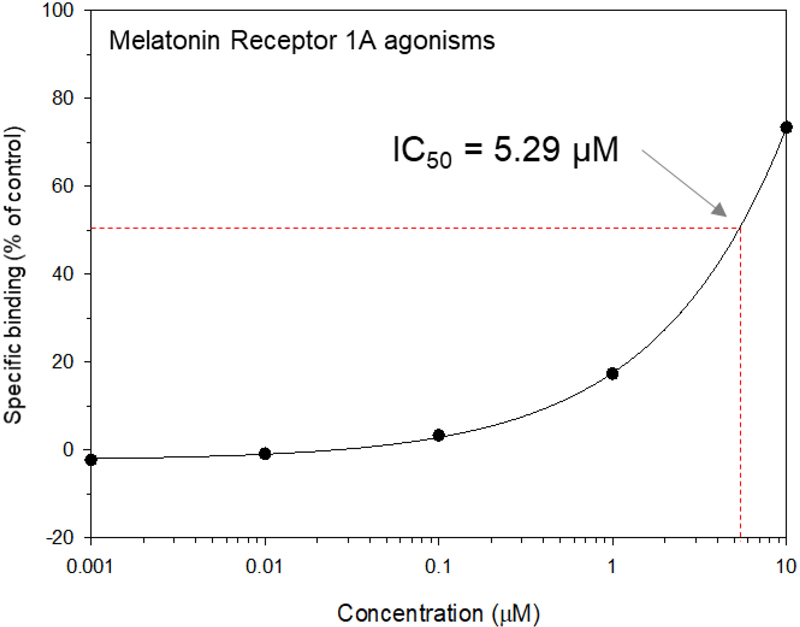
Dose-response curve for melatonin receptor 1A agonism.The graph shows the specific binding of a melatonin receptor 1A agonist as a percentage of the control across different concentrations (0.001–10 μM). The IC₅₀ value, representing the concentration at which 50% of the receptor binding is inhibited, was calculated to be 5.29 μM. The curve indicates a concentration-dependent increase in specific binding, with the red dashed lines marking the IC₅₀ point for reference.
3.3. 수면유도효과 분석 연구
또한, 수면 장애연구를 위해 수면 유도 후 입면시간 및 수면 지속시간을 측정하여 평가하였다. 입면시간은 마우스가 정좌반사가 없어질 때까지의 시간으로 간주하였고, 수면지속시간은 다시 정좌반사가 나타날 때까지의 시간으로 설정하였다. 실험 결과 MPTP 신경독성으로 유발된 마우스의 경우 입면시간은 평균 27.24초(Fig. 3A), 수면지속시간은 평균 56.82분(Fig. 3B)으로 시간이 감소되는 경향성만을 보였다. 또한 엑디손을 복용시킨 마우스의 입면시간은 평균 22.18초, 수면지속시간은 평균 84.30분로 효과적으로 개선함으로서 보다 양질의 수면 유도 효과를 나타낼수 있음을 확인하였다.
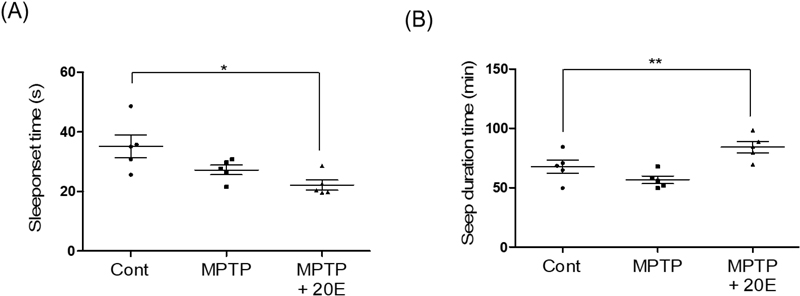
Effects of 20-hydroxyecdysone (20E) on sleep onset time and sleep duration in MPTP-induced Parkinson's disease mouse models.(A) Sleep onset time (seconds) was measured using the alfaxan-induced sleep test. The MPTP group showed a significant reduction in sleep onset time compared to the control group (*p < 0.05). Treatment with 20E significantly improved sleep onset time in MPTP-induced mice.(B) Sleep duration time (minutes) was assessed in the same test. The MPTP group exhibited a significant decrease in sleep duration compared to the control group (**p < 0.01). Administration of 20E significantly prolonged sleep duration in MPTP-induced mice, demonstrating its potential role in improving sleep disturbances.
3.4. 뇌 시상하부에서의 엑디손 수면 자극 바이오마커 분석
본 연구에서는 수면에 관여하는 중추신경 부위인 뇌 시상하부의 신경세포 활성화 바이오마커인 c-fos의 발현을 분석하였다. MPTP로 유도된 마우스의 VLPO 영역에서는 c-fos 발현이 뚜렷하게 관찰되지 않았으나, 엑디손 투여군에서는 c-fos 발현이 유의미하게 증가하였다(Fig. 4). 이는 엑디손이 수면 장애를 개선하는 데 긍정적인 영향을 미칠 수 있음을 시사한다.
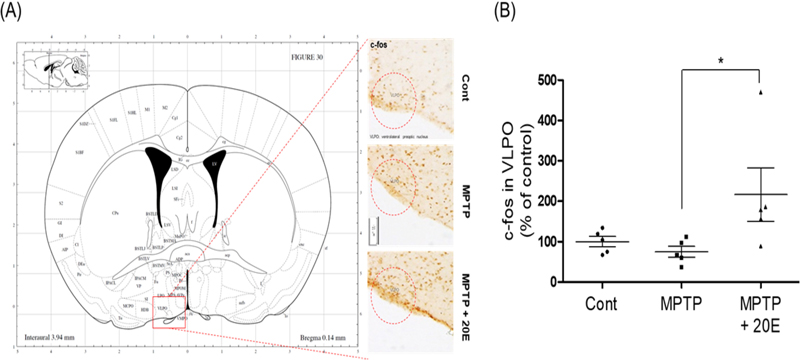
c-Fos expression in the VLPO region of the brain in MPTP-induced Parkinson's disease model.The left panel shows a coronal section of the mouse brain, highlighting the ventrolateral preoptic nucleus (VLPO) region. (A) The right panel displays c-Fos immunohistochemistry results under three conditions: control (Cont), MPTP treatment, and MPTP treatment with 20-hydroxyecdysone (MPTP + 20E). The protein c-fos was measured by immunostaining in mouse VOPL (B).
4. 결 론
파킨슨병은 명확한 원인이 규명되지 않은 퇴행성 뇌질환으로, 유전 요인과 환경적 또는 생활습관적 요인이 상호작용하여 발병한다는 가설이 제시되어 왔다. 최근 연구에서는 대기오염, 특히 이산화질소(NO₂) 과다 노출이 뇌질환 발병에 영향을 미칠 수 있음을 입증하여, 산업화 국가에서 높은 PD 유병률의 일부 원인을 밝혀냈다(Jo et al., 2021). PD는 주로 운동성 증상에 초점이 맞춰져 있지만, 최근 들어 수면장애가 비운동성 증상 중 중요한 문제로 부각되고 있다. PD 환자의 60~90%가 불면증, 렘수면 행동장애, 주간졸림증, 하지불안증후군, 수면무호흡증 등 다양한 수면장애를 경험하며, 이는 환자의 삶의 질을 심각하게 저하시키고 있다(Suzuki et al., 2025).
본 연구에서는 PD 환자의 수면장애와 관련된 메커니즘을 조사하고, 특히 멜라토닌 및 관련 유전자(Mtnr1a)에 초점을 맞췄다. 멜라토닌은 일주기 리듬 (Circadian rhythm)의 조절에 필수적인 호르몬으로, 수면 유도 및 유지에 중요한 역할을 한다(Galvani et al., 2025). STRING 데이터베이스를 활용해 멜라토닌과 관련된 12종의 유전자를 선별한 후, MPTP로 유도된 PD 마우스 모델의 시상하부에서 mRNA-seq 분석을 통해 Mtnr1a의 발현이 가장 감소되었음을 확인하였다. Mtnr1a는 멜라토닌 신호를 전달하는 주요 수용체로, 생체 리듬 조절과 수면 유도에 핵심적인 역할을 한다(Galvani et al., 2025).
엑디손의 효과를 평가하기 위해 Mtnr1a의 결합 친화도(Binding affinity)를 측정한 결과, 5.29 μM에서 50% 효과를 보였다. 또한, Alfaxan 유도 수면시험을 통해 엑디손이 수면 유도시간과 지속시간을 통계적으로 유의미하게 증가시키는 것을 확인하였다. 신경세포 활성 평가를 위해 VLPO 영역에서 c-fos 발현을 분석한 결과, 엑디손 처리군에서 c-fos 발현이 유의미하게 증가함을 관찰하였다. 이는 멜라토닌 수용체의 활성 증가와 관련된 수면 개선 효과를 뒷받침한다(Cirelli et al., 2000).
비록 c-fos 발현 증가만으로 수면장애 개선을 완전히 설명할 수는 없으나, 본 연구는 엑디손이 멜라토닌 신호 전달 경로를 활성화하고, 이를 통해 수면 장애를 개선할 가능성이 있음을 시사한다(Pompeiano et al., 1995; Cirelli et al., 2000). 향후 엑디손의 작용 메커니즘을 구체적으로 규명한다면, PD 환자의 수면장애 치료에 중요한 기여를 할 수 있을 것으로 기대된다. 뿐만 아니라, 건강기능식품 중 수면건강과 관련한 개발에 있어 기초자료로도 사용이 가능할 것으로 사료된다.
Acknowledgments
본 연구는 한국한의학연구원 ‘지속가능한 한약표준자원 활용기술 개발’(KSN1823320) 및 ‘한약자원 미래가치 혁신기술 개발’(KSN2511030) 사업의 지원으로 수행되었다.
References
-
Baumgartner, A., Hirt, L., Amara, A., Kern, D., Thompson J., 2025, Diurnal fluctuations of subthalamic nucleus local field potentials follow naturalistic sleep-wake behavior in Parkinson's disease, Sleep., zsaf005.
[https://doi.org/10.1093/sleep/zsaf005]

-
Browning, C., Beresford, I., Fraser, Neil., Giles, Heather., 2009, Pharmacological characterization of human recombinant melatonin mt1 and MT2 receptors, Bri. J. Pharm., 129, 877-886.
[https://doi.org/10.1038/sj.bjp.0703130]

-
Cirelli, C., Tononi, G., 2000, On the functional significance of c-fos induction during the sleep-waking cycle, Sleep., 23, 453-469.
[https://doi.org/10.1093/sleep/23.4.9]

-
Galvani, F., Cammarota, M., Vacondio, F., Rivara, S., Boscia, F., 2025, Protective activity of melatonin combinations and melatonin-based hybrid molecules in neurodegenerative diseases, J. Pineal. Res., 76, e70008.
[https://doi.org/10.1111/jpi.70008]

-
Jo, S., Kim, Y. J., Park, K. W., Hwang, Y. S., Lee, S. H., Kim, B. J., Chung, S. J., 2021, Association of NO2 and other air pollution exposures with the risk of Parkinson disease, J. Am. Med. Assoc. Neurol., 78, 800-808.
[https://doi.org/10.1001/jamaneurol.2021.1335]

-
Li, Y., Li, Y., Wang, X., Liu, T., Dong, D., Wang, J., Zhao, X., 2025, The steroid hormone 20-hydroxyecdysone induces lipophagy via the brain-adipose tissue axis by promoting the adipokinetic hormone pathway, J. Biol. Chem., 108179.
[https://doi.org/10.1016/j.jbc.2025.108179]

-
Lim, H., Moon, B., Lee, J., Choi, G., Park, G., 2020, The insect molting hormone 20-hydroxyecdysone protects dopaminergic neurons against MPTP-induced neurotoxicity in a mouse model of Parkinson's disease, Free. Radic. Biol. Med., 159, 23-36.
[https://doi.org/10.1016/j.freeradbiomed.2020.07.010]

-
Pompeiano, M., Cirelli, C., Arrighi, P., Tononi, G., 1995, c-Fos expression during wakefulness and sleep, Neurophysiol. Clin., 25, 329-41.
[https://doi.org/10.1016/0987-7053(96)84906-9]

-
Shuvalov, O., Kirdeeva, Y., Fefilova, E., Daks, A., Fedorova, O., Parfenyev, S., Nazarov, A., Vlasova, Y., Krasnov, S., Barlev, A., 2024, 20-Hydroxyecdysone boosts energy production and biosynthetic processes in non-transformed mouse cells, Antioxidants., 13, 1349.
[https://doi.org/10.3390/antiox13111349]

-
Stocchi, F., Bravi, D., Emmi, A., Antonini, A., 2024, Parkinson disease therapy: Current strategies and future research priorities, Nat. Rev. Neurol., 20, 695-707.
[https://doi.org/10.1038/s41582-024-01034-x]

- Suzuki, K., Hiroaki, F., Saro. K., 2025, Managing sleep issues in Parkinson's disease: An Up-to-date review, Expert. Rev. Neurother., 10, 1-16.
-
Wang, Q., Zhu, D., Ping, S., Li, C., Pang, K., Zhu, S., Zhang, J., Comai, S., Sun, J., 2020, Melatonin recovers sleep phase delayed by MK-801 through the melatonin MT2 receptor- Ca2+ -CaMKII-CREB pathway in the ventrolateral preoptic nucleus, J. Pineal. Res., 69, e12674.
[https://doi.org/10.1111/jpi.12674]

Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicineqp1015@kiom.re.kr
Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicinegpark@kiom.re.kr