Aggregation-Induced Emission (AIE) 기반의 Turn-On 형광센서를 이용한 수질 속 중금속 납 이온의 효율적인 검출
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Lead, a heavy metal widely employed in various industries, continues to pose a threat to both human health and the environment. Therefore, the development of a sensor capable of rapidly and accurately detecting lead(II) ions in real-time at contaminated sites is crucial. In this study, we have engineered a fluorescent sensor with the ability to efficiently detect lead(II) ions under actual environmental conditions, including tap water and freshwater. The compound, tetraphenylethylene carboxylic acid derivative (TPE-COOH), exhibits high selectivity and sensitivity toward lead(II) ions in aqueous solution, where the interaction between TPE-COOH and lead(II) ions leads to its aggregation, thus triggering a fluorescence "turn-on" based on the aggregation-induced emission (AIE) mechanism. Impressively, compound TPE-COOH proficiently detects lead(II) ions within a range of 30 to 100 μM in tap water and freshwater, even in the presence of various interfering substances.
Keywords:
Lead(II) ion, Turn-on fluorescence sensors, Aggregation-induced emission (AIE)1. 서 론
전지, 전자제품, 페인트, 차폐재 등 다양한 산업 분야에 사용되는 납은 사람의 건강과 환경을 지속해서 위협하고 있는 중금속 중 하나이다(Claudio et al., 2002; Grant, 2020). 납은 환경이나 생체 내에서 이온 형태로 전환되어 화학적으로 활성이 되며, 물을 마시거나 식품을 섭취하는 과정에서 유기물이나 인체 조직과 상호작용하여 흡수되고 장기에 쌓일 수 있다(Chen et al., 2021). 이러한 납 이온은 생체 내에서 신경계, 혈액, 신장, 심혈관계에 장기적으로 기능 저하 문제를 일으킬 수 있으며, 특히 발달이 진행 중인 어린이에게서는 신경 발달 문제, 행동 변화, 발달 지연, 면역 시스템 저하와 같은 치명적인 문제를 일으킬 수 있는 심각한 독성 물질로 작용한다(Lanphear et al., 2005; Mehta et al., 2022). 세계보건기구(World Health Organization, WHO)에서 정한 음용수에서의 납(II) 이온의 허용 수준은 10 μg/L 이며, 전 세계적으로 건강하고 안전한 식수를 보장하기 위해 이 기준 농도 미만으로 유지되도록 지속적으로 모니터링하고 있다(World Health Organization, 2004). 따라서 납은 환경과 인간의 건강에 위협을 가하는 물질 중 하나이기 때문에 납 이온을 쉽고 신속하게 검출하기 위한 연구가 활발히 진행 중이다(Kim et al., 2012).
오염된 수질에서 납 이온을 정량적으로 확인하기 위한 다양한 물리적, 화학적 검출방법이 개발되었다. 일반적인 검출방법으로는 유도결합 플라즈마 광방출 분광법(ICP-OES), 원자흡수 분광법(AAS)과 같은 방법을 통해 납 이온을 정량화한다(Townsend et al., 1998). 그러나 이와 같은 방법은 정확하고 정량적으로 납 이온을 검출할 수 있지만, 고가의 장비가 필요하고, 전처리와 같은 측정하는데 준비하는 시간이 오래 걸리는 단점이 있다. 최근, coumarin, anthracene, pyrene, rhodamine과 같은 형광체를 이용한 형광화학센서(fluorescence chemical sensor)는 검출 편의성, 실시간 모니터링, 빠른 응답시간, 저렴한 비용 등의 장점을 갖추고 있어 다양한 이온 및 생체분자를 현장에서 즉각적으로 검출하는데 활용되고 있다(Carter et al., 2014; Wu et al., 2017; Lee and Lee, 2020a, 2020b).
지난 수십 년 동안 납 이온을 선택적이고 민감하게 검출하기 위해 다양한 형광센서에 관한 연구가 보고되었다. 그럼에도 불구하고 납 이온의 형광 퀀칭(fluorescence quenching) 효과로 인하여 납 이온에 선택적인 turn-on 형태의 형광센서는 드물게 보고되고 있다(Shaily et al., 2018). 최근 응집 유도 형광 방출인 aggregation-induced emission (AIE) 효과를 기반으로 하는 화학센서는 turn-on 센싱을 하기 때문에 화학센서 분야에서 큰 잠재성을 보이며 주목을 끌어왔다. 특히, tetraphenylethylene(TPE) 유도체는 대표적인 AIE 효과를 나타내는 화합물로 널리 연구되어 왔다(Cai and Liu, 2020). TPE 유도체는 잘 용해되어 분자의 구조가 서로 비틀린 상태에서는 빛을 방출하지 않지만 응집되어 경직된 상태에서 분자의 구조가 평면을 이루게 되면 강한 형광을 나타낸다. 또한 이러한 AIE 효과는 분자의 움직임이 더욱 경직될수록 증가하는 경향이 있어서 TPE 유도체가 수용액에서 특정한 원인에 의해 점점 응집된다면 매우 강한 형광을 방출하게 된다(Hong et al., 2009).
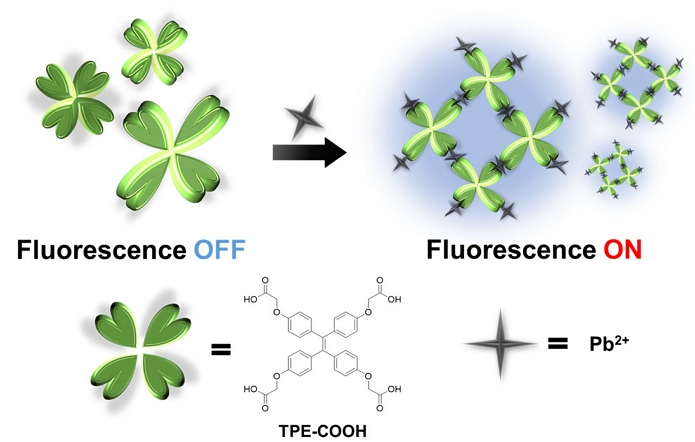
본 연구에서는 수돗물과 담수에서 납 이온을 신속하고 정량적으로 검출할 수 있는 AIE 기반의 turn-on 형광센서를 개발하였다. Fig. 1에서 나타내듯이 AIE 형광체인 TPE에 납 이온과 선택적으로 결합을 할 수 있는 아세트산(acetic acid) 작용기를 접목하여 화합물 TPE-COOH를 합성하였다. 화합물 TPE-COOH는 수용액에서 페닐(phenyl) 고리가 비틀린 형태이기 때문에 형광이 방출되지 않는다. 납(II) 이온은 아세트산 작용기와 결합하여 TPE의 분자간 응집을 유도하고 이로 인해 TPE의 평면화와 분자 내 회전을 제한하여 형광이 증가한다. 본 연구에서는 화합물 TPE-COOH가 납(II) 이온에 의해 응집체를 형성하여 생기는 형광 변화를 관찰하고, 강물 및 수돗물과 같은 실제 조건에서 납(II) 이온을 효과적으로 검출할 수 있는지 연구하였다.
2. 재료 및 방법
2.1. 재료 및 기기
tert-butylbromoacetate와 trifluoroacetic acid은 thermo scientific사(미국)에서 구입하였다. potassium carbonate, iron(III) chloride hexahydrate, iron(II) chloride tetrahydrate, calcium chloride, copper(II) chloride, lead(II) nitrate, zinc chloride, mercury(II) nitrate, cesium chloride는 ㈜대정화금(한국)에서 구입하였다. acetonitrile, ethyl acetate, dichloromethane, hexane, lithium chloride, sodium chloride, potassium chloride, magnesium chloride은 ㈜삼전화학(한국)에서 구입하였다. 합성 화합물의 정제는 Merck 사(미국)에서 구입한 실리카겔(silica gel)을 이용하였다. 그 밖의 사용한 모든 화학 물질 및 용매들은 Sigma-Aldrich(미국)와 Fisher Scientific 사(미국)에서 구매하였다. 모든 시약은 추가 정제 없이 그대로 사용하였다.
NMR 기기는 Bruker 사(미국)의 AVANCE III 400를 사용하였으며, 1H-NMR은 400 MHz에서, 13C-NMR의 경우 100 MHz에서 측정하였다. UV/Vis 흡수 스펙트럼은 Shimadzu사(일본)의 UV-2600i spectrophotometer를 사용하여 측정하였으며, 형광 스펙트럼은 Shimadzu사(일본)의 RF-6000 spectrofluorophotometer를 사용하여 측정하였다. DLS (dynamic light scattering)측정은 Malvern사(미국)의 ZETASIZER NANO S90을 사용하였다.
모든 분광학적 분석과 DLS 측정에는 1cm 크기의 석영 큐벳이 사용되었으며, 화합물 TPE-COOH의 저장 용액(stock solution)은 3 mM으로 DMSO에서 준비하였고, 1.0 × 10-5 M로 희석하여 측정하였다. 흡수 스펙트럼은 350 ~ 600 nm 사이에서 모니터링 하였으며, 형광 스펙트럼은 317 nm에서 조사하여 481 nm에서 형광 방출을 모니터링 하였다.
2.2. 실험방법
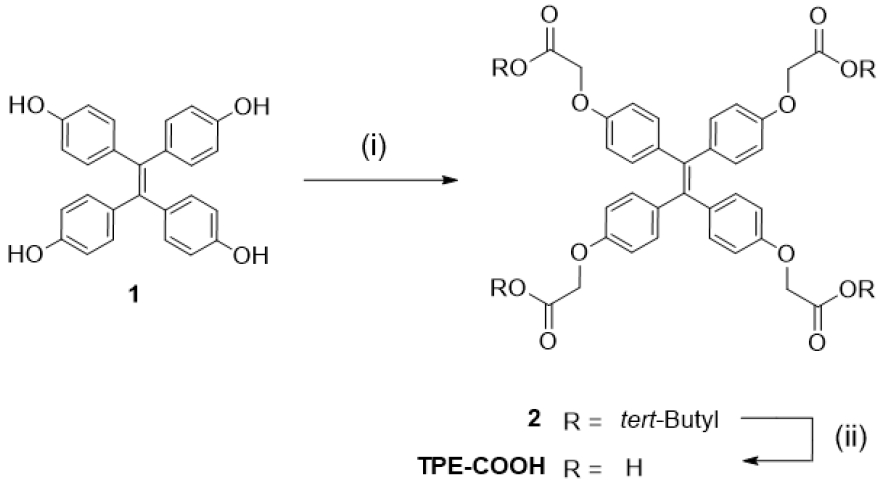
화합물 1(4,4′,4′′,4′′′-(ethene-1,1,2,2-tetrayl)-tetraphenol)은 알려진 절차에 따라 합성하였다(Liu et al., 2022).
100 mL 둥근바닥 플라스크에 아세토나이트릴(acetonitrile) 30.0 mL를 넣고 화합물 1(1 g, 2.52 mmol)과 tert-butyl bromoacetate(2.21 g, 11.34 mmol), K2CO3(1.04 g, 7.56 mmol)을 첨가한 후 반응 혼합물을 80 oC에서 24시간 동안 환류 교반하였다. TLC를 이용하여 출발물질의 스팟과 반응 후의 스팟 비교를 통하여 합성이 완료되었는지 확인한 후 반응을 종결하였다. 회전 증발기를 사용하여 아세토나이트릴 용매를 제거하였다. 다음으로 용매가 제거된 반응 혼합물을 ethyl acetate(200 mL)와 증류수로 녹여준 후, 분별 깔때기에 넣고 ethyl acetate 층을 분리하였다. 생성물질이 용해된 ethyl acetate에 무수 MgSO4를 넣어 물을 제거한 후 여과하였다. 여과한 ethyl aceate는 회전 증발기를 이용해 증발시켜 고체 형태의 생성물을 얻었다. 실리카겔을 고정상으로 한 컬럼 크로마토그래피(ethyl acetate: hexane= 1:4)를 이용하여 순수한 화합물 2를 분리하였으며, 수득률은 80%였다. 1H-NMR(400 MHz, DMSO-d6): δ 6.85 (d, 8H), 6.66 (d, 8H), 4.55 (s, 8H), 1.39 (s, 36H) ppm; 13C-NMR(100 MHz, DMSO-d6): δ 167.80, 155.94, 138.11, 136.64, 131.85, 113.79, 81.32, 64.94, 27.64 ppm.
100 mL 둥근바닥 플라스크에 Dichloromethane 10 mL에 화합물 2(0.50 g, 0.59 mmol)를 녹인 후, trifluoroacetic acid(0.27 g, 2.36 mmol)를 첨가한 뒤 실온에서 10시간 동안 교반하였다. TLC를 이용하여 출발물질의 스팟과 반응 후의 스팟 비교를 통하여 합성이 완료되었는지 확인한 후 반응을 종결하였다. 반응물을 얼름물에 중탕하여 식혀 생성된 고체를 진공 여과기를 사용하여 감압 여과한다. 여과된 고체를 dichloromethane (300 mL)로 충분히 세척한 후 흰색 고체인 화합물 TPE-COOH를 얻었으며, 수득률은 72%였다. 1H-NMR(400 MHz, DMSO-d6): δ 12.95 (s, 4H), 6.85 (d, 8H), 6.68 (d, 8H), 4.58 (s, 8H) ppm; 13C-NMR (100 MHz, DMSO-d6): δ 170.14, 156.01, 138.09, 136.65, 131.93, 113.80, 64.41 ppm.
화합물 TPE-COOH의 저장 용액(stock solution)은 3 mM으로 DMSO에서 준비하였고, 1.0 × 10-5 M로 희석하여 측정하였다. 납(II) 이온에 대한 선택성을 평가하기 위해 철(III) 이온, 마그네슘(II) 이온, 칼슘(II) 이온, 망간(II) 이온, 철(II) 이온, 구리(II) 이온, 아연(II) 이온, 수은(II) 이온, 리튬 이온, 나트륨 이온, 칼륨 이온, 세슘 이온 등이 비교군으로 선택되었으며, 이들 금속이온의 저장 용액은 3 mM으로 물에서 준비하여 사용하였다. 납(II)의 측정농도는 1.0 × 10-6 M부터 2.0 × 10-4 M까지 적가하여 측정하였다. 수돗물은 전처리 과정을 거치지 않은 용액을 사용하였다. 수돗물 2 mL가 담긴 석영 큐벳에 화합물 TPE-COOH을 1.0 × 10-5 M으로 희석한 후 납(II) 이온을 1.0 × 10-6 M부터 2.0 × 10-4 M까지 적가하여 형광 변화를 측정하였다. 담수의 경우 전처리 과정을 거치지 않은 실제 담수 0.6 mL를 증류수 1.400 mL와 혼합하여 30% 담수 혼합용액을 만들어 사용하였다. 혼합용액을 석영큐벳에 옮겨 화합물 TPE-COOH 1.0 × 10-5 M을 넣은 뒤 납(II)의 1.0 × 10-6 M부터 2.0 × 10-4 M까지 적가하여 형광 변화를 측정하였다.
3. 결과 및 고찰
3.1. TPE-COOH의 합성 및 확인
본 연구에서는 Fig. 2에서 나타내듯이 화합물 1을 출발물질로 하여 두 단계의 반응을 통해 화합물 TPE-COOH를 합성하였다. 반응 첫 번째 단계에서는 화합물 1의 hydroxy 작용기에 tert-butyl bromoacetate를 접목하여 약 80%의 수득률로 화합물 2를 합성하였다. 반응 두 번째 단계에서는 화합물 2의 tert-butyl 작용기를 trifluoroacetic acid와 같은 유기 강산을 이용하여 아세트산으로 변환하여 최종적으로 화합물 TPE-COOH를 합성하였다. 합성된 화합물 TPE-COOH의 구조는 1H-NMR 및 13C-NMR 스펙트럼 분석을 통해 확인하였으며, 이때 화합물 TPE-COOH의 NMR 스펙트럼에서는 화합물 2의 tert-butyl 작용기에 해당하는 수소피크(δ 1.39 ppm)와 탄소피크(δ 27.64 ppm)가 관찰되지 않았다. 이 결과를 통해 tert-butyl 작용기가 제거된 최종 화합물 TPE-COOH가 성공적으로 합성되었음을 입증하였다.
3.2. 수용액 상에서의 납(II) 이온 감지
납(II) 이온에 대한 화합물 TPE-COOH의 납이온에 대한 선택성을 확인하기 위해 수질과 관련된 다양한 금속 이온(Fe3+, Mg2+, Ca2+, Mn2+, Fe2+, Cu2+, Pb2+, Zn2+, Hg2+, Li+, Na+, K+, Cs+)에 대해 정제수 조건에서 형광 스펙트럼을 측정하고 각 용액의 형광 변화를 관찰한 결과를 Fig. 3에 나타내었다. 그림에서 보이는 바와 같이 납(II) 이온을 가한 화합물 TPE-COOH는 강한 형광성을 보이지만 다른 중금속 이온에 대해서는 거의 형광 변화를 보이지 않아 화합물 TPE-COOH는 납(II) 이온에 대해 매우 우수한 선택성을 보임을 알 수 있었다(Fig. 3(a)). COOH 작용기가 납(II) 이온과 안정한 착물을 형성함으로써 나타나는 이 선택성은 La 등의 연구 결과에 따르면, 화합물 TPE-COOH가 납(II) 이온과 다중 결합을 통해 상호 응집되어 AIE 효과가 유발되었기 때문이다(La et al., 2018). 뿐만 아니라 Fig. 3(b)에서 확인할 수 있듯이 UV 램프 하에서 납(II) 이온에 대한 강한 형광 방출이 시각적으로 확인되었다. 이는 현장에서 납(II) 이온을 선택적으로 식별하기 위해 화합물 TPE-COOH 센서를 효과적으로 활용할 수 있다는 점을 시사한다. 결국, 화합물 TPE-COOH는 뛰어난 납(II) 이온 선택성을 가지며 다른 경쟁 이온이 존재하는 용액에서도 효과적으로 납(II) 이온을 검출하는 데 활용될 수 있음을 나타낸다.
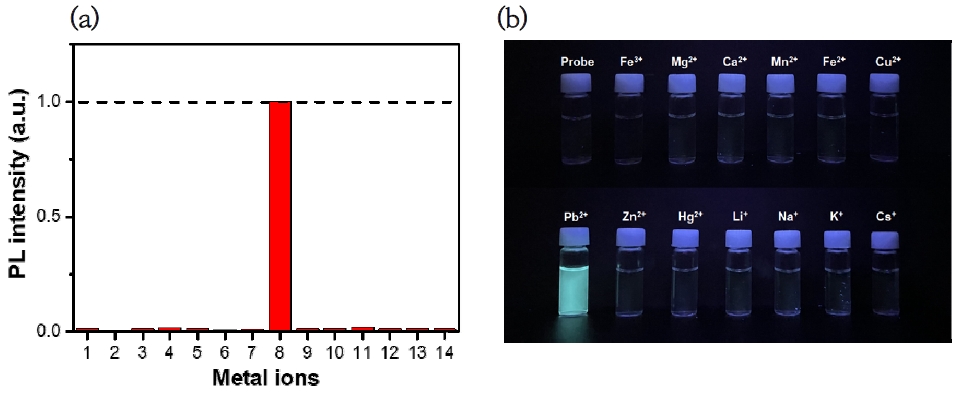
(a) Fluorescence intensity changes and (b) color changes of TPE-COOH (1.0 × 10-5 M) when incubated with various competitive metal ions (1.0× 10-4 M) in H2O. (1) Probe, (2) Fe3+, (3) Mg2+, (4) Ca2+, (5) Mn2+, (6) Fe2+, (7) Cu2, (8) Pb2+, (9) Zn2+, (10) Hg2+, (11) Li+, (12) Na+, (13) K+, (14) Cs+. Excitation was performed at 317 nm and emission was monitored at 481 nm.
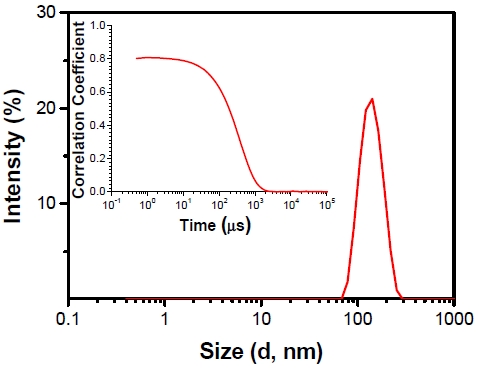
화합물 TPE-COOH가 납(II) 이온과 결합하여 형성되는 응집 현상을 이해하기 위해 동적광산란법(dynamic light scattering: DLS)을 활용하여 분석하였다. DLS 데이터는 화합물 TPE-COOH(1.0 × 10-5 M) 수용액에 납(II) 이온(1.0 × 10-4 M)을 첨가하기 전과 후에 대해 측정되었다. DLS 측정 결과, 납(II) 이온을 첨가하기 전의 화합물 TPE-COOH 용액에서는 DLS 측정값이 관찰되지 않았다. 그러나 납(II) 이온을 첨가한 후, 평균 크기가 133.8 nm로 나타났습니다(Fig. 4). 뿐만 아니라 Fig. 4의 내부 그림에서 나타나듯이, 신호의 상관관계가 감소함에 따라 응집체가 형성된 것으로 나타났다. 이로써 화합물 TPE-COOH의 응집은 비교적 큰 크기와 단일 형태의 입자로 나타났음을 확인할 수 있었다. 결과적으로, 화합물 TPE-COOH의 형광 증가는 수용액에서 용해된 상태로 있는 화합물 TPE-COOH가 납(II) 이온에 의해 응집체를 형성하는 현상에서 기인함을 입증하였다.
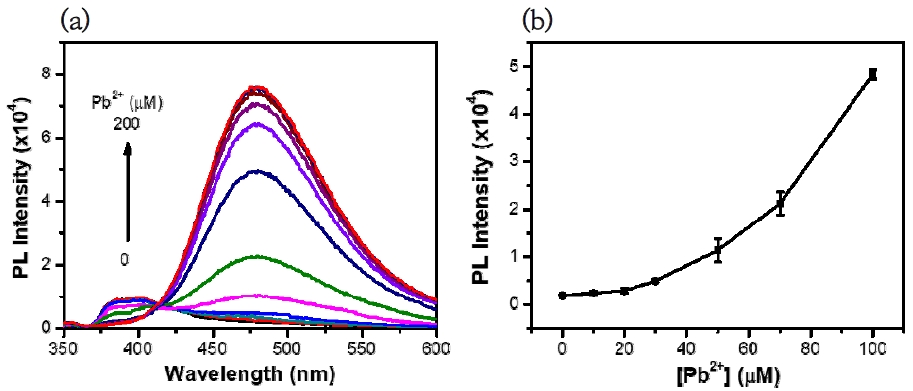
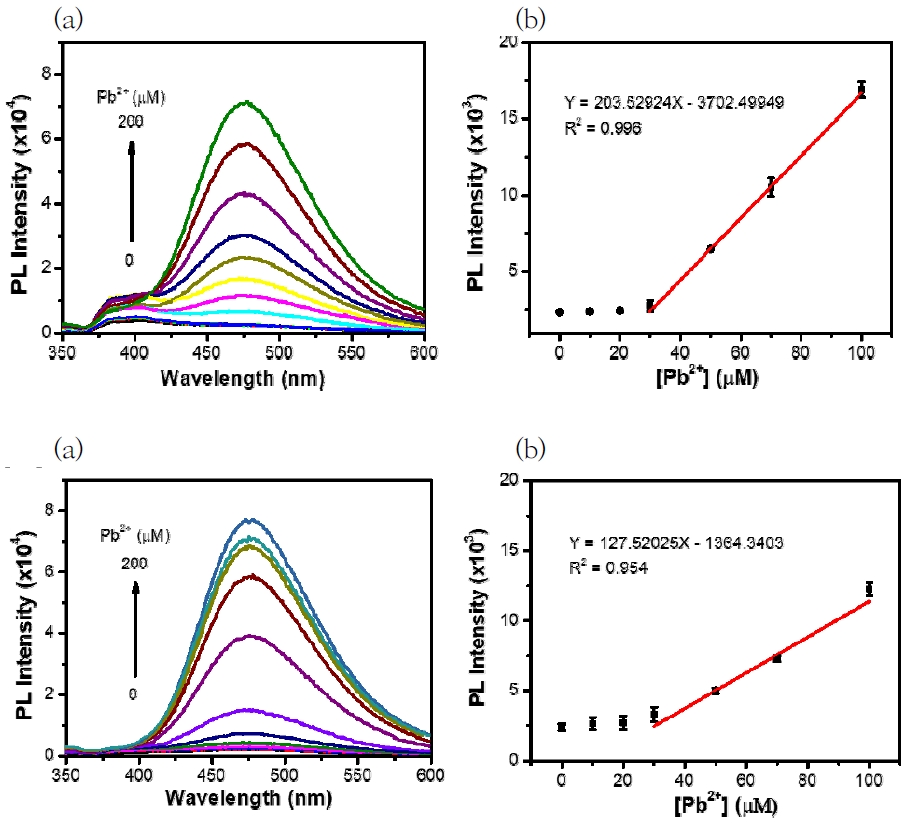
다음으로, 화합물 TPE-COOH의 납(II) 이온에 대한 감응성을 평가하였다. Fig. 5에서 확인할 수 있듯이, 화합물 TPE-COOH(1.0 × 10-5 M) 수용액에 납(II) 이온(0~200 μM)의 농도를 증가시키면서 형광의 변화를 관찰하였다. 결과적으로, 납(II) 이온을 첨가하지 않았을 때의 화합물 TPE-COOH는 납(II) 이온 농도의 증가에 따라 형광 방출이 증가함을 나타냈다. Fig. 5(b)에서 보듯이, 납(II) 이온의 농도가 0~100 μM 범위에서 나타난 형광 변화 그래프는 형광이 어떻게 증가하는지에 대한 효율성을 잘 나타낸다. 이 결과는 개발한 화합물 TPE-COOH를 사용하여 납(II) 이온을 정량적으로 측정할 수 있음을 입증한다.
3.3. 실제 환경조건에서의 감지
화합물 TPE-COOH이 실제 환경조건인 수돗물과 담수에서 납(II) 이온을 효과적으로 검출하는지 확인하였다. 수돗물과 담수에 각각 화합물 TPE-COOH 용액을 첨가한 후 납(II) 이온(0~200 μM)을 적가하여 형광 스펙트럼을 측정하였다(Fig. 6). 정제수에서의 결과와 동일하게 수돗물과 담수에서도 화합물 TPE-COOH은 납(II) 이온이 첨가됨에 따라 형광의 세기가 증가하였다. 또한, 수돗물과 강물에서의 TPE-COOH는 납(II) 이온의 30~100 μM 농도범위에서 형광 방출은 선형관계를 보여준다(Fig. 6(b), 6(d)). 따라서 화합물 TPE-COOH는 다양한 방해 요소가 존재하는 수돗물과 담수에서 납(II) 이온 30~100 μM 농도범위를 정량적으로 측정할 수 있음이 입증되었다.
마지막으로 화합물 TPE-COOH가 수돗물 및 담수에서 특정 납(II) 이온의 농도를 실제로 검출할 수 있는지 검증하였다. 실험은 화합물 TPE-COOH가 용해된 수돗물과 강물에 임의 농도로 납(II) 이온을 첨가하여 형광 스펙트럼을 측정한 후, 이 형광 세기를 Fig. 6b, 6d에서 얻은 선형 추세선에 적용하여 추정한 결과와 첨가된 납(II) 이온의 농도를 비교하였다. Table 1은 임의 농도로 첨가된 납(II) 이온에 대해 선형 추세선을 이용하여 추정한 농도를 비교한 결과이다. 이 결과에서 나타내듯이 첨가된 납(II) 이온에 대해 추정한 값은 높은 회수율(recovery)을 보이며 실제 값과 매우 근사한 결과를 나타냈다. 따라서 화합물 TPE-COOH는 수돗물 또는 담수와 같은 실제 환경에서 오염된 특정 납(II) 이온 농도를 효과적으로 검출할 수 있음이 입증되었다.
4. 결 론
본 연구에서는 실제 환경조건인 수돗물과 담수에서 납(II) 이온을 효율적으로 감지할 수 있는 형광센서를 개발하였다. 화합물 TPE-COOH는 납(II) 이온에 대해 형광의 세기가 증가하는 turn-on 효과를 보이며 높은 선택성과 감응성을 나타내었다. 이러한 turn-on 효과는 화합물 TPE-COOH이 납(II) 이온과 결합시 TPE간의 응집체를 형성한다는 것을 밝힘으로써 AIE 효과에 기인함을 입증하였다. 화합물 TPE-COOH은 다양한 방해물질이 존재하는 수돗물과 담수에서도 30~100 μM 범위의 납(II) 이온 농도에서 좋은 선형관계를 보이며, 납(II) 이온을 효율적으로 검출함을 보여준다. 이 결과로 바탕으로 향후 즉각적으로 납(II) 이온의 검출이 필요한 현장에 활용될 수 있을 것으로 판단된다.
Acknowledgments
이 논문은 2023학년도 대구대학교 학문후속세대 연구과제로 수행되었음.
References
-
Cai, X., Liu, B., 2020, Aggregation-induced emission: recent advances in materials and biomedical applications, Angew, Chem. Int. Ed., 59, 9868-9886.
[https://doi.org/10.1002/anie.202000845]

-
Carter, K. P., Young, A. M., Palmer, A. E., 2014, Fluorescent sensors for measuring metal ions in living systems, Chem. Rev., 114, 4564–4601.
[https://doi.org/10.1021/cr400546e]

-
Chen, S. Y., Li, Z., Li, K., Yu, X. Q., 2021, Small molecular fluorescent probes for the detection of lead, cadmium and mercury ions, Coord. Chem. Rev., 429, 213691.
[https://doi.org/10.1016/j.ccr.2020.213691]

-
Claudio, E. S., Godwin, H. A., Magyar, J. S., 2002, Fundamental coordination chemistry, environmental chemistry, and biochemistry of lead(II), in Karlin, K. D. (ed), Progress in Inorganic Chemistry, 51, Wiely, 1-144.
[https://doi.org/10.1002/0471267287.ch1]

-
Grant, L. D., 2020, Lead and compounds, in Lippmann, M., Leikauf, G. D., (eds.), Environmental Toxicants: Human Exposures and Their Health Effects, Fourth Edition, 17, Wiely, New York, 627–675.
[https://doi.org/10.1002/9781119438922.ch17]

-
Hong, Y., Lam, J. W. Y., Tang, B. Z., 2009, Aggregation-induced emission: phenomenon, mechanism and applications, Chem. Commun., 29, 4332-4353.
[https://doi.org/10.1039/b904665h]

-
Kim, H. N., Ren, W. X., Kim, J. S., Yoon, J., 2012, Fluorescent and colorimetric sensors for detection of lead, cadmium, and mercury ions, Chem. Soc. Rev., 41, 3210-3244.
[https://doi.org/10.1039/C1CS15245A]

-
La, D. D., Bhosale, S. V., Jones, L. A., Bhosale, S. V., 2018, Tetraphenylethylene-based AIE-active probes for sensing applications, ACS Appl. Mater. Interfaces, 10, 12189–12216.
[https://doi.org/10.1021/acsami.7b12320]

-
Lanphear, B. P., Hornung, R., Khoury, J., Yolton, K., Baghurst, P., Bellinger, D. C., Canfield, R. L., Dietrich, K. N., Bornschein, R., Greene, T., Rothenberg, S. J., Needleman, H. L., Schnaas, L., Wasserman, G., Graziano, J., Roberts, R., 2005, Low-level environmental lead exposure and children’s intellectual function: an international pooled analysis, Environ. Health Perspect., 113, 894–899.
[https://doi.org/10.1289/ehp.7688]

-
Lee, J., Lee, S. H., 2020a, Self-assembled micelle-based fluorescence sensor for extremely acidic pH range, J. Environ. Sci. Int., 29, 801-808.
[https://doi.org/10.5322/JESI.2020.29.8.801]

-
Lee, S. Y., Lee, S. H., 2020b, A Pyrenylboronic acid-based fluorescence sensor for highly efficient detection of mercury(II) ions, J. Environ. Sci. Int., 29, 201-207.
[https://doi.org/10.5322/JESI.2020.29.2.201]

-
Liu, L., Zhang, W., Zhong, M. Q., Jia, M. H., Jiang, F., Zhang, Y., Xiao, C. D., Xiao, X., Shen, X. C., 2022, Tetraphenylethene derivative that discriminates parallel G-quadruplexes, RSC Adv., 12, 14765-14775.
[https://doi.org/10.1039/D2RA01433E]

-
Mehta, P. K., Jeon, J., Ryu, K., Park, S. H., Lee, K. H., 2022, Ratiometric fluorescent detection of lead ions in aquatic environment and living cells using a fluorescent peptide-based probe, J. Hazard. Mater., 427, 128161.
[https://doi.org/10.1016/j.jhazmat.2021.128161]

-
Shaily., Kumar, A., Parveen, I., Ahmed, N., 2018, Highly selective and sensitive coumarin–triazole-based fluorometric ‘turn-off’ sensor for detection of Pb2+ ions, Luminescence, 33, 713-721.
[https://doi.org/10.1002/bio.3468]

-
Townsend, A. T., Miller, K. A., McLean, S., Aldous, S., 1998, The determination of copper, zinc, cadmium and lead in urine by high resolution ICP-MS, J. Anal. At. Spectrom., 13, 1213-1219.
[https://doi.org/10.1039/a805021j]

- World Health Organization, 2004, Guidelines for drinking-water quality, 1, 3rd ed., World Health Organization, Geneva, 188.
-
Wu, D., Sedgwick, A. C., Gunnlaugsson, T., Akkaya, E. U., Yoon, J., James, T. D., 2017, Fluorescent chemosensors: the past, present and future, Chem. Soc. Rev., 46, 7105-7123.
[https://doi.org/10.1039/C7CS00240H]

Department of Chemistry, Daegu Universityzx149791@naver.com
Department of Chemistry, Daegu Universitykkhk1707@naver.com
Department of Chemistry & Biosciences, Daegu Universityjuyeon3296@naver.com
Department of Chemistry, Daegu University/Department of Chemistry & Biosciences, Daegu University/Department of Cosmetics & Biomedical Sciences, Daegu Universityslee@daegu.ac.kr