톱밥 및 요소의 투입이 감자 더뎅이병 병원균(Streptomyces scabiei) 및 감자 더뎅이병 이병도 지수에 미치는 영향
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Potato common scab disease is caused by pathogens belonging to Streptomyces spp. and results in a serious yield loss worldwide. Despite decades of research aimed at disease management, a definitive control method remains undiscovered. This study aims to explore the correlation between the C/N ratio and urea application with potato common scab pathogen dynamics and disease severity. We applied sawdust with a high C/N ratio and urea into the soil prior to potato cropping, both in pot and field experiments. Disease severity assessments and quantification of the TxtB gene were conducted at the harvest stage. Furthermore, culture experiments were performed to assess the direct impact of urea on the pathogen. Our findings revealed that higher disease severity was correlated with a high C/N ratio application and pathogenic gene quantity. Urea exhibited a direct influence on S. scabiei activity, reducing the disease severity in pot experiments. However, the effects of urea application on disease suppression in the conductive field were inconclusive. Although the results of urea application experiments displayed inconsistencies between pot and field trials, urea worked as the control to suppress S. scabiei activity. Further investigations are needed under various field conditions to confirm these findings.
Keywords:
Potato common scab disease, Streptomyces scabiei, Sawdust, Urea1. 서 론
생산량을 기준으로 옥수수, 벼, 밀과 더불어 세계 4대 작물로 꼽히는 감자(Solanum tuberosum L.)는 약 150여 국가에서 재배되고 있는 중요한 식량작물이다(RDA, 2020). 감자에 발생하는 대표적인 병 중 하나인 더뎅이병은(potato common scab) 토양 유래의 그람 양성 세균으로 세균과 사상균의 중간적 성질이 있는 Streptomyces 속에 속하는 몇몇 종이 원인균으로 병원균의 균사나 포자가 괴경에 침입하여 괴경 표면에 갈색의 반점을 형성한다. 병원균은 식물체 내로 침입한 후 Thaxtomin 이라고 하는 식물 독소를 생성하여 세포벽을 부수고 빠르게 세포 내로 침투하게 되며, 병반 주변부는 솟아올라 요철상태가 된다(George, 2005).
감자 더뎅이병은 발병 정도에 따라 피해가 다르지만 심한 경우는 상품수량의 90%까지 손실을 일으켜 이를 방제하고자 많은 연구가 수행되어 왔다(Hong et al., 2003; Braun et al., 2017). 더뎅이병의 발병에는 토양환경적인 측면에서 보면 토양 pH, 토양 온도, 수분, 토성 등이 관여하고 있고 감자의 측면에서는 감자의 생육시기, 감자의 품종이 관여하고 있으며, 재배 관리적인 측면에서는 작부체계와 투입 유기물의 종류 등이 관여하고 있다는 것이 밝혀졌다(Hooker, 2001; Fiers et al., 2012). 특히, 토양 pH와 수분이 가장 큰 영향을 주는 것으로 보고되었다.
감자 더뎅이병의 병원균이 분리된지 100년 이상 되었고(Thaxter, 1891), 많은 연구자들이 감자 더뎅이병을 방제하기 위해 화학적 방제, 재배 관리적인 방법(Locci, 1994; Sturz et al., 2004; Wiggins and Kinkel, 2005; Larkin et al., 2011), 생물적 방제(Han et al., 2005; Hiltunen et al., 2009; St Onge et al., 2011), 저항성 품종의 육종(Pasco et al., 2005; Driscoll et al., 2009) 등 다양한 노력을 하였으나 더뎅이병에는 다양한 요인들이 관여되어 있어서 효과적인 관리법이 필요한 실정이다. 토양을 훈증하는 화학적 방제를 제외하고 현재 감자의 더뎅이병 이병도를 감소시키기 위해 추천되는 방법은 유황을 넣어 토양 pH를 낮추고, 부숙된 유기물을 투입하고, 콩과작물 및 녹비 작물과 돌려짓기를 하고, 감수성 품종을 재배하는 것이다(Dees and Wanner, 2012).
본 연구에서는 더뎅이병의 이병도 및 병원균의 밀도에 탄질비가 높은 유기물인 톱밥을 투입하는 것이 영향을 주는지를 밝히고, 요소 비료(Urea, CH4N2O)의 투입이 더뎅이병 이병도와 병원균에 미치는 영향을 화분과 포장에서 시험하여 감자 더뎅이병에 대한 이해를 높이고자 하였다.
2. 재료 및 방법
2.1. 화분 시험
국립식량과학원 고령지농업연구소에 위치한 온실(37.6808681, 128.7306057)에서 난방을 하지 않고 3월에서 11월에 화분 시험을 수행하였다. 화분시험에 사용된 토양은 상토(쑥쑥이, 농우바이오, 상토2호, 초경량)에 더뎅이병이 잘 나올 수 있는 조건을 맞추기 위해서 소석회를 상토 2500 L 당 7.8 kg을 섞어서 pH 수준을 7.5-7.8 수준으로 조정하였다. 화분의 1개의 크기는 80 x 80 x 40 cm로 화분에 상토를 가득 채운 후 1개 화분에 16개의 씨감자를 파종하였다. 감자 품종은 더뎅이병 감수성 품종인 대지 품종을 사용하였다. 씨감자는 고령지농업연구소에서 전년도에 생산된 병에 걸리지 않은 감자를 사용하였으며, 파종 전 소독하여 싹을 틔운 후 50-100 g 크기의 씨감자를 골라서 자르지 않고 파종하였다. 씨감자의 소독은 1%의 NaOCl에 15분간 침지 후 수돗물로 10분 간 침지 후 세척을 3번 수행하였다. 시험에 사용된 병원균은 국립농업과학원 유전자원센터에서 분양받은 Streptomyces scabiei(KACC no. 20192) 균주를 접종하였다. 병원균은 LB 배지에서 배양 후 600nm에서의 흡광도값이 0.8-1.0 수준에 해당하는 시기(28°C, 200 rpm, 3-4일)에 1개의 화분 당 2L의 배양액을 투입하였으며, 병원균이 처리되지 않은 시험구에도 동량의 LB 배지를 투입하였다. 본 연구에서는 총 3번의 화분시험을 수행하였으며, 파종일로부터 약 100일 후 발병도 조사를 수행하였다.
투입 유기물의 C/N률이 더뎅이병의 발병도에 영향을 주는지 알아보기 위해 수행한 화분시험에서는 유박(토토유박, 풍농)과 톱밥을 처리구로 사용하였다. 상토와 씨감자 소독을 위에서 설명한 바와 동일하게 수행한 후 질소함량을 고려하여 화분 한 개 당 유박 150 g, 톱밥 1 kg을 투입하여 잘 섞어주었다. 유박과 톱밥의 특성은 Table 1에 표시하였으며, 유박은 약 10.1의 C/N률을 톱밥은 약 118.2의 C/N률을 나타내었다. 처리는 1) 유박 단독 처리구, 2) 톱밥 단독 처리구, 3) 유박과 병원균 혼합처리구, 4) 톱밥과 병원균 혼합처리구, 5) 아무것도 처리하지 않은 대조구, 6) 병원균만 처리한 대조구 의 6개 처리로 구성하여 각 처리 당 3반복으로 수행하였다.
유기물의 투입 및 요소의 투입이 더뎅이병 발병도에 미치는 영향을 확인하기 위하여 수행된 화분시험에는 미숙퇴비, 완숙퇴비, 톱밥, 요소, 그리고 국립농업과학원 농업유전자원센터에서 분양받은 Rhizobium miluonense(KACC no. 10996)를 사용하였다. 미숙퇴비와 완숙퇴비는 국립축산과학원 가금연구소에서 제공받은 계분을 사용하였으며, 미숙퇴비는 퇴비부숙을 전혀 거치지 않은 계분을 사용하였고, 완숙퇴비는 퇴비부숙기를 한 달 이상 거치 계분을 사용하였다. 미숙퇴비와 완숙퇴비는 각 화분 당 2 kg 씩, 톱밥은 1 kg, 요소는 500 g, R. miluonense는 1 L의 LB 배지에서 24시간 배양(28 ᵒC, 280 rpm)한 후 600 nm에서의 흡광도 수치가 0.8-1.0 수준일 때 화분에 접종을 하였다. 위에서 설명한 것과 같이 상토를 준비하여 화분에 준비한 후 퇴비처리 시험구에 퇴비를 잘 섞고 일주일 후 R. miluonense, 톱밥, 그리고 요소를 투입한 후 감자를 파종하였다. 처리구는 총 8개 처리구로 1) 아무것도 처리하지 않은 무처리구, 2) 미숙퇴비만 처리한 처리구, 3) 병원균만 처리한 처리구, 4) 병원균과 완숙퇴비를 처리한 처리구, 5) 병원균과 미숙퇴비를 처리한 처리구, 6) 병원균과 톱밥을 처리한 처리구, 7) 병원균, 톱밥 그리고 요소를 처리한 처리구, 8) 병원균, 톱밥, 그리고 R. miluonense를 처리한 처리구를 3반복으로 시험을 수행하였다.
요소 투입이 더뎅이병 발병 감소에 영향을 주는지 확인하기 위하여 시험이 끝난 화분실험-유기물/요소 시험구 중 요소를 투입하지 않은 1) 무처리구, 3) 병원균 처리구, 5) 병원균과 미숙퇴비 처리구, 8) 병원균, 톱밥, R. miluonense 처리구의 화분을 반으로 나눠 요소를 100 g 씩 투입하여 후속시험을 수행하였다.
2.2. 포장 시험
국립식량과학원 고령지농업연구소 강릉 시험포장(37.7736880, 128.9359009)의 감자 더뎅이병이 상시발생하고 있는 시험포장에서 요소의 투입이 더뎅이병 발병도와 관련이 있는지 확인하기 위해 포장시험을 2021년 봄과 가을에 3 m x 10 m 의 시험구에서 반복 없이 수행되었다. 시험 포장에 대한 정보는 Table 2에 나타내었다. 봄 재배는 3월 초에 가을 재배는 8월 초에 퇴비와 비료를 투입하고 로터리 작업을 수행한 후 흑색비닐멀칭을 하였으며, 약 열흘 후에 감자를 파종하였다. 모든 처리구에 표준재배법에 준하는 동일한 양의 완숙퇴비가 투입(2000 kg/10a) 되었으며, 감자의 품종은 화분시험과 동일한 대지 품종을 사용하였고, 재식간격은 80 x 25 cm 로 파종하였다. 요소 처리는 시험구 당 1.8 kg 씩 처리하였으며, 처리구는 1) 대조구인 원예복비(슈퍼 21, 남해화학) 표준시비량 투입구, 2) 요소 기비 처리구, 3) 개화기 요소 추비 처리구 로 시험을 수행하여 파종 후 약 100일에 발병도 조사를 수행하였다.
2.3. 상토 및 토양 분석
상토의 화학성 분석은 시험 전과 발병도 조사일에 각 시험구에서 상토를 채취하여 수행하였는데, 동일 처리구의 상토를 일정량 채취하여 시료봉투에 넣어 고르게 섞은 후 직사광선이 들어오지 않는 장소에서 48시간 이상 건조시킨 후 믹서로 분쇄하여 분석시료로 사용하였다. 시험포장의 토양 화학성 분석은 로터리 작업 전에 포스트 홀 핸드 오거(auger)를 사용하여 표토(5-15 cm)의 토양을 채취하여 분석하였다. 토양시료의 채취는 동일 시험구에서 5지점의 토양을 시료봉투에 넣어 고르게 섞은 후 직사광선이 들어오지 않는 장소에서 48시간 이상 건조시킨 후 2mm 체로 쳐서 분석시료로 사용하였다.
토양 분석 항목은 pH, 유기물, 유효인산, 치환성 양이온(K, Ca, Mg, Na), 전기전도도(EC, Electric conductivity), 그리고 토성 이었으며, 분석 방법은 농업과학기술원 토양 및 식물체 분석법(NIAST, 2002)에 준하여 다음의 방식으로 분석하였다. pH와 전기전도도는 초자전극법, 유기물함량은 Vario Max(Hanau, Germany) CN으로 탄소함량을 측정한 후 환산하였고, 유효인산함량은 Lancaster 방법에 따라 UV 720 nm(UV/VIS spectrometer, Lamda 25, Perkinelmer Co., Norwalk, CT, USA)에서 측정하였으며, 치환성 양이온함량은 토양샘플을 1 M의 NH4OAc 추출액으로 침출하여 유도결합질량분석기(Inductively Coupled Plasma Spectrometer, Optima 2100DV, Perkin Elmer Co., USA)로 분석하였고, 토성은 비중계법으로 분석하였다. 상토 분석 항목은 pH, 탄소와 질소의 함량, 유기물, 그리고 유효인산이었으며 분석방법은 토양분석방법과 동일하게 수행하였다. 탄소와 질소의 함량은 상기에 기술한 Vario Max(Hanau, Germany) CN으로 탄소와 질소의 함량을 측정하였다.
2.4. 배지실험
요소가 직접적으로 더뎅이 병원균의 생장에 영향을 주는지 알아보기 위해 수행하였으며, 더뎅이 병원균인 Streptomyces scabiei가 잘 자라는 50%의 오트밀 배지를 이용하여 실험을 수행하였다. 50% 오트밀 배지 1L 기준으로 요소 0, 0.5 g, 1.0 g, 1.5 g, 2.0 g, 3.0 g, 그리고 5.0 g의 7단계의 농도, pH는 7.5로 조정하여 90 x 150 mm 페트리 디쉬에 배지를 만든 후 화분시험에서 사용한 것과 동일한 균주인 Streptomyces scabiei를 10% TSB(Tryptic soy broth) 배지에서 이틀간 배양(28°C, 250 rpm) 후 600 nm에서의 흡광도 수치가 0.8-1.0 수준일 때를 기준으로 10-2 희석한 병원균 접종액을 배지 당 100 μl 씩 spreading하여 28°C에서 일주일간 배양하여 결과를 확인하였다.
일반적으로 감자를 재배할 때 많이 사용하는 복합비료에서의 더뎅이 병원균의 반응을 확인하기 위해 복합비료를 사용한 실험도 함께 수행하였다. 재료로 쓰인 비료는 파워감자(한국협화) 로 11-8-9-2-0.2(%), 질소-인산-칼리-고토-붕소를 함유하고 있는 복합비료이다. 이 비료를 위와 동일한 pH를 7.5로 조정한 50% 오트밀 배지 1 L 기준으로 복합비료 0, 0.5 g, 1.5 g, 2 g, 4 g, 6 g, 8 g, 10 g을 넣어 배지를 만든 후 동일한 양의 병원균 희석액을 접종한 후 28°C에서 일주일간 배양하여 결과를 확인하였다.
2.5. TxtB gene 정량분석
병원균이 분비하는 Thaxtomin 생합성과 관련이 있는 유전자인 TxtB를 검출하는 primer를 이용하여 화분실험에서 채취한 상토 샘플의 DNA로부터 TxtB 유전자를 real time PCR(QuantStudio 3, Applied Biosystems, USA)을 사용하여 정량분석하였다. 정량분석에 사용한 primer set는 다음과 같으며(Qu, Wanner and Christ, 2008), 시험에 사용한 병원균주인 S.scabiei(KACC no. 20192)의 DNA로 PCR을 수행한 결과 해당 primer set의 양성반응을 확인하였다.
- Strep F (5’-GCAGGACGCTCACCAGGTAGT-3’)
- Strep R (5’-ACTTCGACACCGTTGTCCTCAA-3’)
상토 샘플의 채취는 수확기 조사 때 모종삽을 이용하여 처리 당 3 반복의 화분에서 상토를 시료봉투에 채취하여 잘 섞어주었다. 시료 채취 전 모종삽은 70% 에탄올로 소독 후에 토양 시료를 채취하였다. 채취한 시료는 DNA 추출 전까지 -20°C에 보관하였으며, 처리 당 5반복으로 토양 DNA 추출 키트(NIPPONGENE, PowersoilⅡ, Japan)를 이용하여 DNA를 추출하였다. 추출한 DNA는 분광광도계(Nanodrop, DS-11, Denovix, USA)을 이용하여 정량한 후, 모두 5 ng/μl의 농도로 희석하였다. Real time PCR의 조건은 denature 15 초, annealing/extension 30초로 45 cycle을 수행하였으며, 정량분석에 사용한 Standard는 병원균주 S.scabiei의 DNA농도를 1로 희석한 것을 10-6까지 연속희석하여 검량선을 만들어 정량분석하였다.
2.6. 더뎅이병 이병도 지수 (Common scab disease severity) 조사
감자 더뎅이병의 이병도 지수(%)는 농업과학기술 연구조사 분석기준(RDA, 2012) 에 준하여 조사하였다. 화분시험에서는 화분 당 감자를 16주씩 심었으며 반복 당 3개 화분의 감자를 모두 조사하였고, 포장시험에서는 시험구 당 20주에서 수확한 감자를 대상으로 이병도지수를 산출하였다. 이병도 지수는 아래의 식으로 산출하였다.
| (1) |
- * B~F는 각 이병도지수에 속하는 감자의 수
- * 이병도지수 기준:
- 1-병반 1~2개 또는 병반 전체 넓이 1 cm2이하,
- 2-병반넓이 10% 이하, 3-병반넓이 11-25%,
- 4-병반넓이 26-50%, 5-병반넓이 51% 이상
2.7. 통계 분석
본 시험에서 수행한 모든 통계분석은 R 프로그램(4.2.3)을 이용하여 수행하였으며, 처리에 따른TxtB 유전자의 분산 분석은 R 프로그램에 내장된 기본 패키지를 이용하여 분석을 수행한 후 5% 이상에서 통계적 유의차가 인정 되면 agricolae 패키지를 사용하여 bonferroni 분석을 사용하여 사후 검정을 수행하였다. 또한, 토양 이화학성 성분, TxtB 유전자 그리고 더뎅이병 발병도와의 상관 분석은 R 프로그램의 corrplot 패키지를 사용하였으며, spearman 상관계수를 사용하여 분석을 수행하였다.
3. 결과 및 고찰
3.1. 유기물 및 요소투입에 따른 더뎅이병 이병도 지수 및 TxtB 유전자의 정량분석 결과 비교
탄질률이 10배 이상 차이가 나는 톱밥(탄질률 118) 과 유박(탄질률 10) 처리의 화분시험 결과 탄질률이 낮은 유박에 비해 탄질률이 높은 톱밥을 투입한 화분에서 높은 더뎅이병 이병도 지수(CS severity)를 확인할 수 있었다(Fig. 1A.). 톱밥 투입으로 인한 더뎅이병 이병도 증가가 질소기아 현상과 관련이 있는지를 확인하기 위해 요소와 질소 고정균인 Rhizobium miluonense를 투입하는 후속 시험을 계획하였다. 또한, 계분의 부숙 정도가 더뎅이병의 이병도에 유의한 영향을 미치는지를 2차 화분 시험에서 함께 확인하였다.
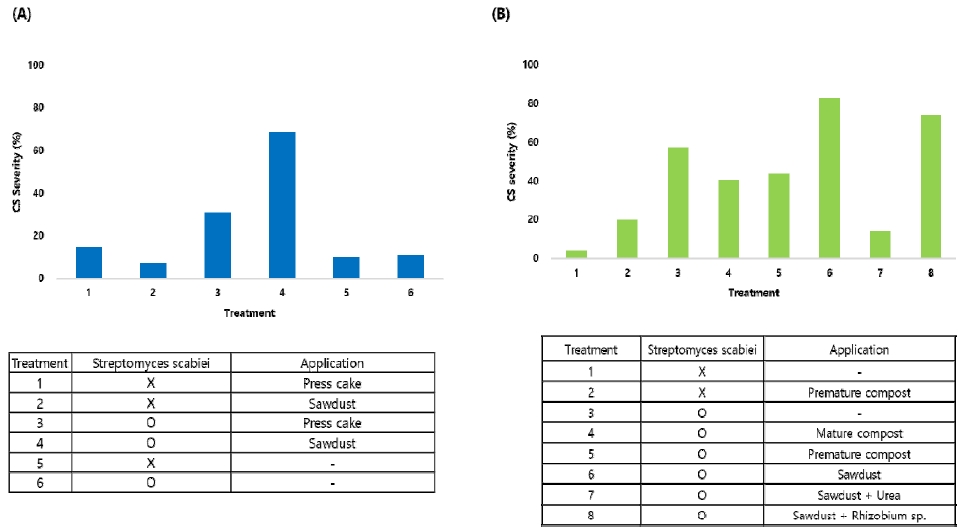
The disease severity of potato common scab (CS) in accordance with organic matter and urea treatment in pot experiment.
2차 시험 결과, 톱밥, 요소 및 질소고정균 처리에 따른 이병도 지수는 1차 화분 시험과 동일하게 톱밥 처리구에서 60% 이상의 높은 이병도 지수를 보였다. 톱밥에 요소를 함께 처리할 경우 이병도 지수가 크게 감소하였으나, R. miluonense 균을 처리한 경우에는 더뎅이병 이병도 지수의 유의한 감소를 확인할 수 없었다(Fig. 1B.). 한편, 미숙 계분과 완숙 계분 처리구의 이병도 지수는 큰 차이를 보이지 않음으로써 계분의 부숙도에 따른 이병도 지수의 차이도 확인할 수 없었다.
감자 재배 시 안정적인 수량을 얻기 위해서는 유기물의 투입이 필요하다. 그러나 유기물의 투입은 감자 더뎅이병의 발병을 증가시키는데, 유기물 투입에 따른 더뎅이병 발병 경향은 환경에 따라 그 결과가 일정하지 않았다(Cohn and Lazarovits, 1999; Larkin and Tavantzis, 2013; Joa et al., 2014). 투입 퇴비의 종류 및 부숙도에 따른 더뎅이병 이병도에 대한 선행 연구 결과, 더뎅이병 발병이 심한 포장에서 미숙 및 부숙 우분 퇴비를 투입하여 더뎅이병 이병도 지수를 비교하였을 때 유의한 차이가 없었으며(N’Dayegamiye et al., 2013), 우분과 계분을 투입하여 비교한 연구에서는 일정한 경향을 나타내지 않았다(Cohn and Lazarovits, 1999).
더뎅이 병원균이 속해 있는 Streptomyces sp. 는 몇 백 종의 다양한 species가 속해있으며, 이들 중 대부분은 병원성이 없다(Hooker et al., 2001). Streptomyces 병원균이 감자에 병징을 나타내는 것은 병원균의 thaxtomin의 생성에 기반하기 때문에 병원균의 탐색은 thaxtomin을 생합성하는 유전자의 유무로 확인할 수 있다. 본 시험에서는 화분시험의 상토를 채취하여 그들의 DNA로부터 thaxtomin 생합성과 관련이 깊은 TxtB 유전자의 정량분석을 수행하여 처리에 따른 병원균의 밀도 변화를 추정하였다.
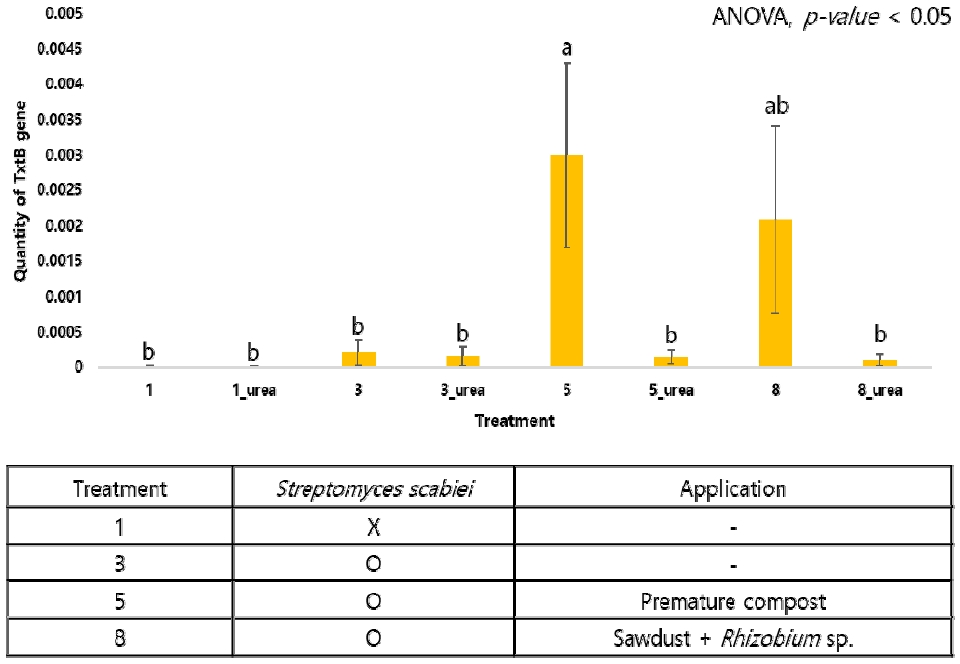
그 결과, 다른 처리구에 비해 톱밥 처리구에서 TxtB 유전자가 유의하게 증가하였으며(Fig. 2A), 이병도 지수 결과(Fig. 1)와 동일한 경향으로 톱밥과 요소를 함께 처리할 때 TxtB 유전자가 급격히 감소하는 것을 확인할 수 있었다. 또한, 이병도 지수의 결과(Fig. 1B)에서는 큰 차이를 보이지 않았으나 부숙 퇴비 처리구는 미숙 퇴비 처리구보다 낮은 양의 TxtB 유전자가 확인되었으며(Fig. 2B), 톱밥과 R. miluonense 처리구에서도 톱밥 단독처리구에 비해 감소된 TxtB 유전자를 나타내었다(Fig. 2B). 이는 부숙 퇴비의 사용과 질소고정균의 처리가 더뎅이병 이병도 지수에 유의한 영향을 주지는 못하였으나 병원성 Streptomyces 종의 밀도를 감소시킬 수 있었다는 것을 의미한다.
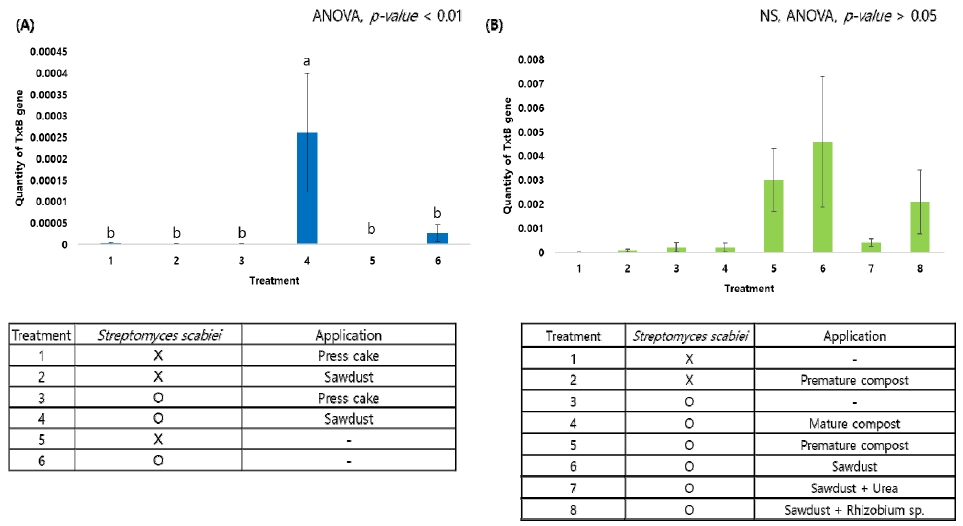
The results of quantitative PCR for TxtB gene depending on organic matter and urea treatment in pot experiment (Average ± Standard error, NS: No significance).
Thaxtomin의 합성은 복합 탄수화물 뿐 아니라 cellobiose, cellotriose, suberin과 같은 식물의 기원이 되는 물질들로 인해 유도되므로(Lerat et al., 2010) 유기물의 투입은 Streptomyces 종의 밀도를 증가시킬 수 있다. 더뎅이 병원균이 부생균이기 때문에 특히 미숙한 퇴비의 사용은 이들의 밀도를 더욱 증가시킬 수 있으므로 지속적으로 미숙 계분을 시용할 경우 더뎅이병의 발병 가능성을 높일 수 있음을 시사하였다.
3.2. 요소 (CH4N2O)가 더뎅이병원균 S. scabiei 에 미치는 영향
화분 시험 결과 요소의 투입이 더뎅이병 이병도 지수를 감소시켰기 때문에 요소가 더뎅이병 발병에 미치는 영향을 확인하기 위해 추가 시험을 진행하였다. 2차 화분 시험이 끝난 후 대조구를 포함하여 더뎅이병 이병도 지수가 40% 이상 발생하였던 1처리(병원균도 다른 유기물도 투입하지 않은 처리), 3처리(병원균만 투입한 처리), 5처리(미숙퇴비, 병원균 투입 처리), 8처리(톱밥, R. miluonense, 병원균 투입 처리)에 해당하는 화분에 요소를 투입하여 후속 화분 시험을 수행하였으나 요소를 투입한 화분에서 씨감자의 발아가 제대로 이루어지지 않아서 이병도 지수의 조사는 수행하지 못하였다. 비록 발아가 제대로 되지 않아 더뎅이병 이병도 지수의 조사는 어려웠으나, 요소 투입 약 3달 후 채취한 상토의 DNA로 TxtB 유전자의 정량분석을 수행하여 요소를 투입하기 전과 비교한 결과 모든 처리에서 요소를 투입한 후 TxtB 유전자가 감소된 것을 확인할 수 있었다(Fig. 3).
식물체의 생장에 필수적인 질소는 토양 내에서 고농도로 존재하면 독성을 띄게 되며, 감자는 이러한 독성에 민감한 식물에 속한다(Britto and Kronzucker, 2013). 요소를 토양에 투입하면 암모니아 형태(NH4+)로 식물체가 이용할 수 있게 되는데, 본 화분시험을 수행하였을 때는 장마 기간으로 온실 내에 빛이 잘 들지 않아 습도가 다소 높았던 것이 토양 내 암모니아 독성 수치와 씨감자의 발아에 영향을 주었을 것으로 생각된다. 또한, 요소 비료는 토양에 시용하면 암모니아로 변하므로 증가한 암모니아의 독성 때문에 더뎅이 병원균의 밀도가 줄어들었을 것으로 추측된다(Dees and Wanner, 2012).
요소가 직접적으로 더뎅이 병원균인 Streptomyces scabiei의 활성에 영향을 주는지 확인하기 위해 배지 내에 직접 요소와 감자를 재배할 때 일반적으로 사용하는 복합화학비료를 넣어 실험을 수행하였다. 그 결과, 요소 무처리구인 대조구와 비교하여 colony의 수가 줄어들지는 않았으나 활성에는 영향을 주는 것으로 판단되었다. 대조구에서는 병원균의 colony가 형성된 후 모든 colony에서 시간이 지날수록 하얗게 포자를 형성한 반면 요소 처리구에서는 요소의 함량이 증가할수록 포자를 형성하지 못하였고, 1.5 g/L 이상의 농도에서는 colony 크기가 작아지는 것이 관찰되어 요소 자체가 더뎅이 병원균인 Streptomyces scabiei 의 생육에 부정적인 영향을 줌을 추측할 수 있었다(Fig. 4A).

The suppression of Streptomyces scabiei growth according to urea treatment in vitro (pH was adjusted as 7.5).
질소 성분 뿐 아니라 인산과 칼리 등이 함께 포함된 복합비료의 처리구의 경우도 대조구와 비교하여 복합비료 처리구에서 colony가 작아지거나 포자가 형성되지 못하는 것이 관찰되었으나, 상당히 높은 농도처리인 6-8 g/L 처리구에서는 포자가 잘 형성되어 요소 단일 처리구와 같이 일정한 경향을 보이지는 않았다(Fig. 4B).
요소의 투입이 병원균의 생육을 직접적으로 억제하지만 토양 화학성에도 영향을 줄 것으로 생각이 되어 요소 처리구와 무처리구의 토양 pH, N content, C content, 유기물, 그리고 토양 내 유효인산을 분석하여 비교하였다. 그 결과 처리에 따라 조사한 모든 항목에서 유의한 차이를 확인할 수 있었다. 요소 처리구에서는 대조구와 비교하여 pH가 감소하였고, 질소함량이 증가하였다 (Table 3).
토양 내 탄소와 질소를 포함한 유기물, 유효인산, pH, TxtB 유전자, 그리고 더뎅이병 발병도 간의 상관분석 결과 TxtB 유전자와 토양 C가 더뎅이병 이병도 지수와 유의한 양의 상관관계를 보임을 알 수 있었다(Fig. 5). 특히, 토양 N은 더뎅이병 이병도 지수와 유의한 상관관계를 보이지 않은 반면, 토양 C는 유의한 양의 상관관계를 보였는데, 이는 탄질률이 높은 유기물의 투입이 더뎅이병의 발생도 증가에 유의한 영향을 준다는 것을 뒷받침해줄 수 있는 결과로 생각된다.
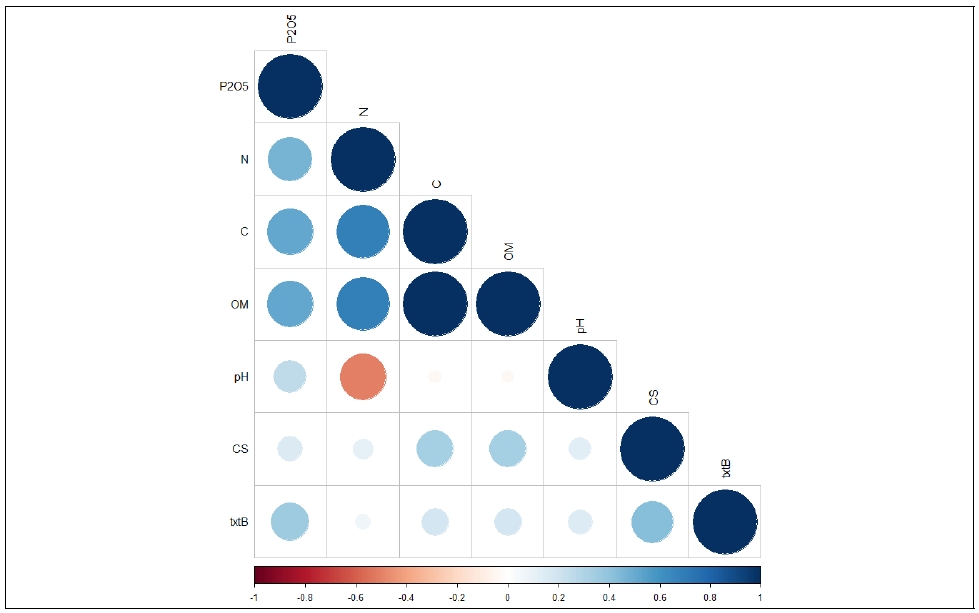
The results of correlation analysis among common scab severity (CS), soil chemical properties and TxtB gene quantity, CS: Common scab severity, OM: organic matter.
Sagova-Mareckova et al.(2015)의 연구에서도 토양 내 낮은 탄소와 질소함량, 그리고 탄질률이 낮은 더뎅이병 발병도와 관련이 있다고 보고하였다. 또한, 탄질률 50 이상의 퇴비들의 투입이 무처리구와 비교하여 더뎅이병의 이병도지수를 증가시켜 본 시험 결과와 일치하는 경향을 보였(Larkin and Tavantzis, 2013)다. 그러나 탄질률이 15-20 수준의 paper mill sludge를 더뎅이병 발병이 심한 포장에 투입했던 경우에는 탄질률의 차이가 더뎅이병 발병에 유의한 영향을 끼치지 않았다(N’Dayegamiye et al., 2013). 즉, 탄질률이 높은 유기물을 투입할 시 더뎅이병 이병도 지수가 증가할 가능성이 높으나 이미 병원균의 밀도가 높은 포장에서는 투입 유기물의 효과가 미비할 것으로 생각된다.
화분시험 및 배지실험을 통해 더뎅이병 이병도 지수가 C/N률이 높은 톱밥을 투입하였을 때 더뎅이병의 이병도 지수가 크게 증가하며, 요소의 처리가 병원성 더뎅이균을 감소시키고 더뎅이 병원균의 활성을 직접적으로 억제함을 알 수 있었다. 요소 투입으로 인한 더뎅이병 이병도의 감소가 포장에서도 유효한지를 확인해보기 위해 봄, 가을 2회에 걸쳐 포장시험을 수행하였다. 시험을 수행한 포장은 전년도에 중도 저항성 품종을 재배하였을 때 더뎅이병 이병도 지수가 80% 이상 발생하였던 더뎅이병 상습발병 포장이었다. 그 결과, 봄 재배에서는 요소를 기비로 처리한 시험구에서 대조구와 비교하여 이병도 지수가 조금 감소하였으나, 가을 재배에서는 요소 기비구와 추비구 모두 대조구보다 높은 이병도 지수를 보여 요소 투입에 따른 더뎅이병 이병도 감소효과를 확인할 수 없었다(Fig. 6).
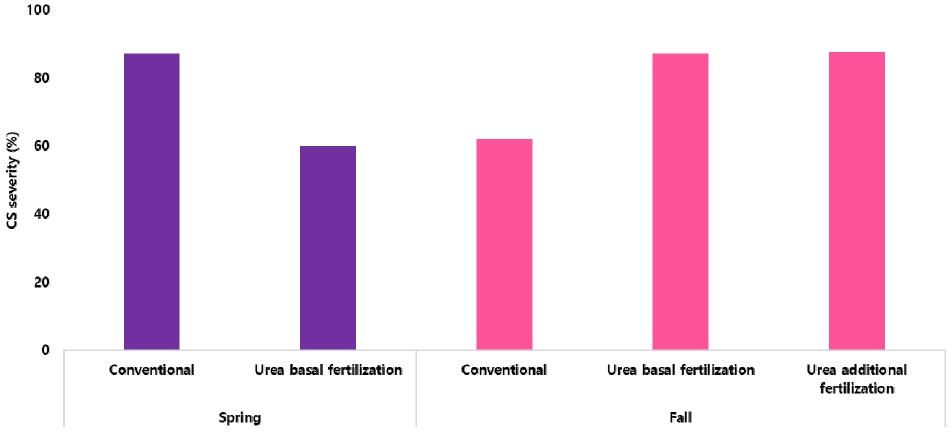
Potato common scab severity (CS) in accordance with urea treatment in agricultural field during spring and fall season cropping.
Urea-formaldehyde를 포장에 투입하여 더뎅이병 방제를 시도하였던 선행연구에서는 감자 파종 시 고랑에 일정 수준의 Urea-formaldehyde를 시용함으로써 높은 방제효과를 얻었다고 보고하여(Weinhold et al., 1964) 포장에서도 유효한 방제효과를 보고한 바 있다. 그러나 더뎅이병 발병이 심한 포장에 여러 종류의 유기물과 질소 무기비료를 시용한 연구에서는 유기물 종류 및 무기비료 투입에 따른 발병도 차이를 보이지 않았다(N’Dayegamiye et al., 2013). 즉, 더뎅이 병원균의 밀도가 높아 이병도 지수가 높은 포장에서는 유기물의 종류나 요소 비료에 따른 방제 효과를 확인하기 어려운 것으로 생각되며, 병원균의 밀도가 어느정도 수준 이하인 포장에서 시험할 경우 다른 결과를 얻을 수도 있을 것으로 생각한다.
4. 결 론
감자 더뎅이병의 발병은 환경적으로도 유전적으로도 다양한 요인이 관여하고 있어서 지금까지 많은 연구가 수행되었으나 아직도 더뎅이병의 발병과 관련하여 명확히 밝혀지지 않은 부분이 많다. 본 연구에서는 화분시험에서 탄질률이 높은 유기물인 톱밥 투입에 따른 이병도 지수의 증가 및 요소 처리에 따른 더뎅이병 이병도 지수의 감소를 확인하였으며, 토양 및 투입 유기물의 탄질비가 더뎅이병의 발병도에 유의한 영향을 줄 가능성이 높음을 고찰하였다. 또한, 요소 처리에 의한 더뎅이병 이병도 지수의 감소가 요소가 직접적으로 더뎅이 병원균의 활성에 영향을 주고 있음을 시사하였으나, 더뎅이병 상습 발병 포장에서 요소 투입에 따른 더뎅이병 이병도 지수 감소는 확인할 수 없었다. 그러나 이병도 지수가 높은 상습 발병 포장에서는 처리에 따른 효과가 미비할 수 있고, 더뎅이병 발병에는 다양한 요인이 관여하고 있기 때문에 보다 다양한 환경의 시험포장에서 후속 연구를 수행할 필요성이 있다.
Acknowledgments
이 논문은 농촌진흥청 연구사업 “감자 난방제 병해에 대한 미생물 활용 방제연구” (과제번호: PJ014866032021)에 의해 지원되었음.
References
-
Braun, S., Gevens, A., Charkowski, A., Allen, C., Jansky, S., 2017, Potato common scab: a review of the causal pathogens, management practices, varietal resistance screening methods, and host resistance, Am. J. Potato. Res., 94, 283-296.
[https://doi.org/10.1007/s12230-017-9575-3]

-
Britto, D. T., Kronzucker, H. J., 2013, Ecological significance and complexity of N-source preference in plants, Ann. Bot., 112, 957-963.
[https://doi.org/10.1093/aob/mct157]

-
Cohn, K. L., Lazarovits, G., 1999, Impact of animal manures on verticillium wilt, potato scab, and soil microbial populations, Can. J. plant pathol., 21(1), 81-92.
[https://doi.org/10.1080/07060661.1999.10600089]

-
Dees, M. W., Wanner, L. A., 2012, In search of better management of potato common scab, Potato Res., 55, 249-268.
[https://doi.org/10.1007/s11540-012-9206-9]

-
Driscoll, J, Coombs, J., Hammerschmidt, R., Kirk, W., Wanner, L., Douches, D., 2009, Greenhouse and field nursery evaluation for potato common scab tolerance in a tetraploid population, Am. J. Potato Res., 86(2), 96-101.
[https://doi.org/10.1007/s12230-008-9065-8]

-
Fiers, M., Edel-Hermann, V., Chatot, C., Hingrat, Y. L., Alabouvette, C., Steinberg, C., 2012, Potato soil-borne disease, A review, Agron. Sustain. Dev., 32, 93-132.
[https://doi.org/10.1007/s13593-011-0035-z]

- George, N. A., 2005, Disease cycle of common scab of potato caused by Streptomyces scabies, in Plant pathology, 5th ed., Elsevier, Amsterdam, Netherlands, 674-678.
-
Han, J. S., Cheng, J. H., Yoon, T. M., Song, J., Rajkarnikar, A., Kim, W. G., Yoo, I. D., Yang, Y. Y., Suh, J. W., 2005, Biological control agent of common scab disease by antagonistic strain Bacillus sp. sunhua., J. Appl. Microbiol., 99(1), 213-221.
[https://doi.org/10.1111/j.1365-2672.2005.02614.x]

-
Hiltunen, L. H., Ojanpera, T., Kortemaa, H., Richter, E., Lehtonen, M. J., Valkonen, J. P. T., 2009, Interactions and biocontrol of pathogenic Streptomyces strains co-occurring in potato scab lesions, J. Appl. Microbiol., 106(1), 199-212.
[https://doi.org/10.1111/j.1365-2672.2008.03992.x]

-
Hong, S. Y., Hahm, Y. I., Kang, Y. K., 2003, Developmental characteristics of potato common scab in Jeju Island, Res. Plant Dis., 9(3): 137-1440.
[https://doi.org/10.5423/RPD.2003.9.3.137]

- Hooker, W. J., 2001, Compendium of potato diseases, 2nd ed., American phytopathological society, St. Paul, MN, USA, pp14-15.
-
Joa, J. H., Moon, D. K., Koh, S. W., Daniel, S., 2014, Effect of applying soil amendments on potato scab prevention in Volcanic ash soil with continuous cropping system, Korean J. Org. Agri., 22(4), 719-730.
[https://doi.org/10.11625/KJOA.2014.22.4.719]

- Kim, G. H., Kim, G. Y., Kim, J. H., Sa, D. M., Seo, J. S., Shon, B. G., Yang, J. I., Um, G. C., Lee, S. E., Jung, G. Y., Jung, D. Y., Jung, Y. T., Jung, J. B., Hyun, H. N., 2014, Soil Science, 2nd ed., HyangMunSa Publishing Co., Seoul, Korea, 265-267.
-
Lambert, D., Loria, R., 1989, Stretomyces acidiscabies SP-Nov. Int. J. Syst. Evol. Microbiol., 39, 393-396.
[https://doi.org/10.1099/00207713-39-4-393]

-
Larkin, R. P., Honeycutt, C. W., Griffin, T. S., Olanya, O. M., Halloran, J. M., He, Z. Q., 2011, Effects of different potato cropping system approaches and water management on soilborne disease and soil microbial communities, Phytopathology., 101(1), 58-67.
[https://doi.org/10.1094/PHYTO-04-10-0100]

-
Larkin, R. P., Tavantzis, S., 2013, Use of biocontrol organisms and compost amendments for improved control of soilborne diseases and increased potato production, Am. J. Potato res., 90, 261-270.
[https://doi.org/10.1007/s12230-013-9301-8]

-
Lazarovits, G., Conn, K. L., Potter, J., 1999, Reduction of potato scab, verticillium wilt, and nematodes by soymeal and meat and bone meal in two Ontario potato fields, Can. J. Plant Pathol., 21, 315-353.
[https://doi.org/10.1080/07060669909501170]

-
Lerat, S., Simao-Beaunoir, A., Wu, R., Beaudoin, N., Beaulieu, C., 2010, Involvement of the plant polymer suberin and the disaccharide cellobiose in triggering thaxtomin A biosynthesis, a phytotoxin produced by the pathogenic agent Streptomyces scabies, Phytopathology., 100(1), 91-96.
[https://doi.org/10.1094/PHYTO-100-1-0091]

-
Locci, R., 1994, Actinomycetes as a plant pathogen, Eur. J. Plant Pathol., 100, 179-200.
[https://doi.org/10.1007/BF01876235]

- National institute of agricultural science and technology (NIAST), 2002, Methods of soil chemical analysis, National institute of agricultural science and technology, RDA, Suwon, Korea.
-
N’Dayegamiye, A., Nyiraneza, J., Giroux, M., Grenier, M., Drapeau, A., 2013, Manure and paper mill sludge application effects on potato yield, nitrogen efficiency and disease incidence, Agronomy., 3, 43-58.
[https://doi.org/10.3390/agronomy3010043]

-
Pasco, C., Jouan, B., Andrivon, D., 2005, Resistance of potato genotypes to common and netted scab causing species of Streptomyces. Plant pathol., 54, 383-392.
[https://doi.org/10.1111/j.1365-3059.2005.01178.x]

-
Qu, X., Wanner, L. A., Christ, B. J., 2008, Using the TxtAB operon to quantify pathogenic Streptomyces in potato tubers and soil. Phytopathology, 98(4), 405-412.
[https://doi.org/10.1094/PHYTO-98-4-0405]

- Rural development administration (RDA). 2012. Agricultural science and technology research survey analysis standard, Suwon, Korea.
- Rural development administration (RDA), 2020, Technical manual on quality seed potato production with a focus on hydroponics, 1st ed., Jeonju, Korea, pp6-7.
-
Sagova-Mareckova, M., Daniel, O., Omelka, M., Kristufek, V., Divis, J., Kopecky, J., 2015, Determination of factors associated with natural soil suppressivity to soil potato common scab, PLoS ONE., 10(1), e0116291.
[https://doi.org/10.1371/journal.pone.0116291]

- Stevenson, W. R., Loria, R., Franc, G. D., Weingartner, D. P., 2001, Compendium of potato disease. 2nd ed., St. Paul: The American phytopathological society.
-
St-Onge, R., Gadhar, V. J., Arseneault, T., Goyer, C., Filion, M., 2011, The ability of Pseudomonas sp. LBUM 223 to produce phenazine-1-carboxylic acid affects the growth of Streptomyces scabies, the expression of thaxtomin biosynthesis genes and the biological control potential against common scab of potato, FEMS. Microbiol. Ecol., 75(1), 173-183.
[https://doi.org/10.1111/j.1574-6941.2010.00992.x]

-
Sturz, A. V., Ryan, D. A. J., Coffin, A. D., Matheson, B. G., Arsenault, W. J., Kimpinski, J., Christie, B. R., 2004, Stimulating disease suppression in soils: sulphate fertilizers can increase biodiversity and antibiosis ability of root zone bacteria against Streptomyces scabies, Soil Biol. Biochemi., 36(2), 343-352.
[https://doi.org/10.1016/j.soilbio.2003.10.009]

- Thaxter, R., 1891, The potato “scab”. Connecticut Agricultural experiment station annual report, pp81-95.
-
Weinhold, A. R., Bowman, T., Bishop, J., 1964, Urea-formaldehyde for the control of common scab of potato, Am. Potato J., 41, 319-321.
[https://doi.org/10.1007/BF02855666]

-
Wiggins, B. E., Kinkel, L. L., 2005, Green manures and crop sequences influence potato diseases and pathogen inhibitory activity of indigenous streptomycetes, Phytopathology, 95(2), 178-185.
[https://doi.org/10.1094/PHYTO-95-0178]

National Institute of Crop sciencebgl1228@korea.kr
National Institute of Crop scienceleejt@korea.kr
National Institute of Crop sciencejsnnimp@korea.kr