
실내 관상용 물재배에서 염분농도에 따른 3가지 관엽식물의 내염성 평가
ⒸThe Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study investigated the growth characteristics of Euonymus japonicus, Hedera helix, and Peperomia puteolata treated with different calcium chloride (CaCl2) concentrations to evaluate salt tolerance limits in hydroculture cultivation. Six concentrations of CaCl2 (0, 1, 2, 5, 10, and 15 g·L-1 referred to as Cont., C1, C2, C5, C10, and C15) were applied to solution grown plant species. The survival rate, growth index, plant height, plant width, leaf width, leaf length, number of leaves, and relative chlorophyll contents were measured at monthly intervals. Euonymus japonicus, Hedera helix, and Peperomia puteolata survived up to C2, C5, and C10 at each CaCl2 concentration. The Euonymus japonicus was higher in the C1 treatment than in the Cont. for most growth characteristics. Hedera helix had the highest leaf width, leaf length, and number of leaves in the Cont., a significant difference was observed compared with the C1 treatment. The chlorophyll content did not differ significantly between the C5 and Cont. treatments. The leaf width and length of Peperomia puteolata were greater in the C2 and C1 treatments than in the Cont., whereas the number of leaves and chlorophyll content were the highest in C5. Dry weight analysis revealed that Euonymus japonicus, Hedera helix, and Peperomia puteolata were the lowest in the Cont. treatments. Euonymus japonicus was 74% in C15, and and Peperomia puteolata were analyzed at approximately 37%- 50% and 9%-14%, respectively, regardless of the concentration in the CaCl2 treatment groups. In indoor hydroponic cultivation, the salt tolerance limit concentrations of Euonymus japonicus, Hedera helix, and Peperomia puteolata are 2, 5, and 10 g·L-1, respectively, indicating that hydroculture management techniques should be applied at higher concentrations.
Keywords:
Euonymus japonicus, Hedera helix, Interior landscaping, Salt stress, Tap water, Peperomia puteolata1. 서 론
급격한 이상기후로 인하여 식물은 건조, 염류, 고온 및 저온 등의 다양한 환경요인에 대해 받는 스트레스가 증가하고 있다(Kim et al., 2020). 특히, 토양의 모든 수용성 무기 성분을 합하여 토양 염류라고 하며, 수목에 대한 염류 피해는 생장 억제, 엽록소 함량의 변화, 기공전도도 및 광합성 저하 등으로 나타난다(Garcı́a-Sánchez et al., 2002). 최근 수행되고 있는 식물의 내염성에 관한 연구를 살펴보면 주로 염생식물의 NaCl 염분농도에 따른 생리 반응에 관한 연구가 이루어져 왔다. Jeong et al.(2013)은 대표적인 염생식물인 퉁퉁마디의 적정 염농도를 알아보고자 NaCl 농도를 각각 달리 처리한 결과, NaCl 200 mM에서 생육이 좋았고, 500 mM 이상의 염농도에서도 재배가 가능하다고 보고하였다. 같은 염생식물인 나문재의 경우 50 mM에서 초장, 분지수, 광합성 효율 등이 최적의 생육 상태를 보였지만 고염조건에서도 광합성 효율을 유지할 수 있는 생리적 특성으로 400 mM의 넓은 범위의 염농도에서도 생육이 가능하다고 하였다(Kim et al., 2019). 이외에도 CaCl2 처리에 따른 식물 생육 반응 연구는 제설제에 노출된 도심 가로녹지 내 식재된 식물을 대상으로 한 토양 염류 피해에 대한 연구 등이 진행되어 왔으나(Ju et al., 2019; Yang et al., 2020), 실내 관상용 물재배에서 염분농도에 따른 관엽식물의 내염성에 관한 연구는 미흡한 실정이다.
일반적으로 수경재배(hydroponics)의 경우 채소(토마토, 상추, 오이, 고추)는 물론 허브, 장미, 관엽식물과 같은 관상용 식물을 대규모로 생산하는 것 뿐 아니라 일상에서 가정용으로 쉽게 꽃과 채소를 기르는 소규모 농업의 형태로 확대되고 있다(Shrestha and Dunn, 2010). 한편, 물재배(hydroculture)는 수경재배와 달리 영양분 공급, 식물생장조절제, 작물활성제 등이 사용되지 않으며, 피트모스, 버미큘라이트, 펄라이트 등과 같은 인공배지 또한 필요하지 않다는 장점을 가지고 있다(Clapa et al., 2013). 특히 관엽식물은 대부분 열대 및 아열대 원산으로 음지나 반음지 조건에서 잘 자라기 때문에 실내조경 또는 분화용 물재배로 활용도가 증가하고 있다(Shim and Kwon, 2010). 이러한 실내 관상용 물재배는 주기적인 물주기에 대한 부담이 없어 일반인의 활용도가 점차 증가하고 있다. 하지만, 물재배용 화분은 하단에 배수공이 없어 잉여 수분이 외부로 유출되지 않을 뿐 아니라 장기적인 수분공급은 배지 내 잔류염류 농도가 높아질 수 있다(Ju et al., 2019). 실제로 토양 및 지하수에 함유되는 과도한 염 농도는 내염성이 약한 식물의 생산성을 저해하는 요인이 된다(Kim et al., 2002). Loudari et al.(2020)은 토마토 수경재배 시 염 스트레스가 지상부와 지하부의 무기 영양 흡수에 불균형을 초래한다고 하였다. 목화(Gossypium arboreum)의 경우, 염 농도 증가로 종자 발아가 억제되었고, 유묘의 수경재배에서도 생존율이 저하된다고 보고하였다. 이렇듯 염분은 식물에 있어 수분이용효율을 감소시키고 영양분의 불균형을 초래하는 주요한 환경적 요인중 하나이다 (Lolaei, 2012). 하지만 실내에서 관상용 물재배 시 지속적인 염분축척에 따른 배지환경 변화와 관엽식물의 내염성에 관한 연구는 미흡한 실정이다. 따라서 본 연구에서는 관상용 물재배 시 관엽식물로 이용도가 높은 금사철, 아이비, 페페로미아 등 3종의 염분농도 처리에 따른 배지환경 변화 및 생육 반응을 살펴보고 내염성을 평가함으로써 대규모의 실내조경 또는 실내정원용 식재수종으로서의 가능성과 관엽식물 일반인의 소비촉진을 위한 염분관리기법에 활용하고자 수행하였다.
2. 연구재료 및 방법
2.1. 연구재료
식물재료는 잎을 관상하는 대중적인 실내식물인 금사철(Euonymus japonica), 아이비(Hedera helix), 페페로미아(Peperomia clusiifolia)로(Jang et al., 2013), 종별 크기가 비교적 균일한 식물을 구입하였다. 화분에서 꺼낸 후 뿌리의 상토를 제거하기 위해 수돗물로 세척한 뒤 염분처리된 수용액에 수종별로 침지하였다. 물재배 용기로 100 mL 삼각플라스크(Schott Duran Erlenmeyer Flask)를 사용하였으며, 수분증발을 통한 농도 변화를 방지하기 위하여 용기 입구에 파라필름(Parafilm)을 부착하였다. 일반적으로 전기전도도(EC)가 4 dS·m-1 이상인 경우 염류토양이라고 하며, 식물의 염화나트륨(NaCl)을 기준으로 염분스트레스 임계값은 80 mM 로 보고되고 있다(Barbafieri et al., 2023). 이에 물재배에서는 이보다 낮은 수준의 범위로, 순도 74%의 분말 염화칼슘(CaCl2, Oriental Chemical Industries, Korea)을 사용하여 증류수 1 L당 0(Cont.), 1(C1), 2(C2), 5(C5), 10(C10), 15 g(C15), 즉 0, 6.67, 13.34, 33.34, 66.7 mM의 총 6가지 염분농도로 구성하였다.
2.2. 연구방법
3종의 관엽식물을 각 처리구마다 완전임의배치법 3 반복하여 총 180개의 화분을 2023년 3월부터 7월까지 약 4개월간 충북 충주시 소재 대학교 캠퍼스 온실 내에서 실험을 수행하였다. 염분농도 처리에 따른 수용액 환경변화는 산도와 전기전도도를 중심으로 조사하였으며, 산도는 pH Meter (Orion 420A, Orion, USA)로, 전기전도도(EC)는 EC meter (CON510, Eutech instruments, Singapore)를 이용하여 측정하였다. 식물의 생육측정은 생존율, 생장지수, 초장, 초폭, 엽폭, 엽장, 엽수, 상대엽록소함량, 생체중, 건물중, 건물률 등을 조사하였다. 생존율은 각 처리구별 생존 식물수/전체 식물수 × 100(%)로 하였으며, 생장지수(GI: Growth Index)는 [(초폭1)+(초폭2)]/2+초장)/2의 산정식으로 계산하였다(Hammond et al., 2007). 상대엽록소함량은 휴대용 엽록소측정기(SPAD-502, Minolta, Japan)로 잎의 중앙부 근처를 5반복하여 모니터링하였다. 실험 종료 후, 식물체를 수거한 후 지상부와 지하부로 나누어 72℃의 열풍건조기(C-DF, Changshin Sci Co, Korea)에서 48시간 건조한 다음 생체중과 건물중으로 건물률(건물중/생체중 × 100%)을 산출하였다(Kwack et al., 2014). 본 연구에서 수집된 데이터는 SPSS statistics 27(SPSS Inc., Chicago, USA) 프로그램을 활용하여 Duncan의 다중검정법으로 통계처리 하였으며 유의수준 5%로 하였다. 그래프는 Sigmaplot 12.3(Systat, San Jose CA, USA)을 이용하여 나타내었다.
3. 결과 및 고찰
3.1. 염분농도에 따른 수용액의 산도 및 전기전도도 변화
물재배 시 염화칼슘 농도에 따른 각 배지의 산도(pH) 변화는 다음과 같다(Fig. 1). 금사철의경우, 실험구를 조성하였던 3월에는 pH 7보다 높았는데 대조구인 Cont.에서 7.17, C5 처리구가 7.6으로 염기성을 보였다. 반면 7월에는 C1, C2 처리구가 각각 4.06, 4,21로 pH 5를 넘는 다른 처리구에 비해 비교적 산도가 산성으로 변화되었다. 아이비는 3월경 pH 7.24-7.65의 중성-약알칼리성을 띄었으나 7월에는 C2 처리구가 pH 3.33으로 강산성이었고, C1 처리구는 pH 4.45, Cont.를 비롯한 다른 처리구는 pH 5 정도의 약산성으로 수용액의 특성이 변화하였다. 페페로미아의 경우, 3월에는 모든 실험구에서 pH 7 이상의 알칼리성이었으며, 염분농도에 따른 처리구간 변화는 없었다. 반면, 7월에는 C1 실험구가 pH 6.48로 중성에 가까운 산도를 보였고, 이외의 처리구는 pH 6 이하의 약산성으로 나타났다. 이에 장기간의 수돗물 공급으로 인한 염류집적은 실내 관엽식물의 근권 환경에 악영향을 줄 수 있으며, 양분흡수 저해 뿐 아니라 지상부의 생육 또한 가시적인 피해를 입을 수 있어 관리대책 마련이 필요하다고 하겠다. 실제 산도(pH)는 배지 내 무기 영양소의 가용성을 제어하는데 수경재배 시 권장되는 pH는 5.0 ~ 6.0으로 전반적으로 영양소의 가용성이 약산성 pH에서 최적화되기 떄문이다(Shrestha and Dunn, 2010). Lee et al.(2004)는 절화장미 수경재배 시 배양액의 pH가 4.0-6.0에서 광합성률과 증산률이 높게 나타나는 것으로 보고하고 있어, 시간이 경과함에 따라 대부분의 처리구에서 pH 5 수준으로 낮아지며 식물 생육에 안정된 pH를 보였다. 이는 pH는 처리와 무관하게 기간에 따라 감소하였다는 Furlani et al.(2004)의 연구 결과와도 유사한 경향이었다.
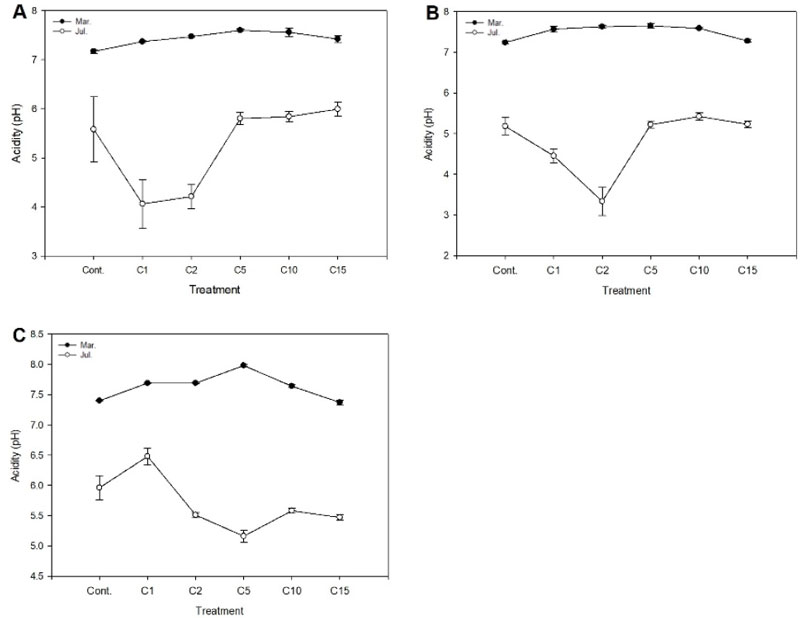
Change of acidity in solution grown Euonymus japonicus (A), Hedera helix (B), and Peperomia puteolata (C) for a period March (●) and July (○) months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture. Vertical bars represent SEs of 9 treatments. Calcium chloride (CaCl2) were added to the solution to prepare the saline solution. Cont: non-treatment, C1, C2, C5, C10, and C15: CaCl2 1, 2, 5, 10, and 15 g·L-1, respectively.
염분농도에 따른 수용액의 전기전도도는 처리농도가 높을수록 증가하는 경향을 보였다(Fig. 2). 금사철은 경우 Cont., C1, C2 처리구에서 3월에 비해 7월에 전기전도도가 높아진 반면 C5, C10, C15는 낮아졌으며 3월에 비해 7월경 실험구간 변화폭이 적어졌다. 아이비는 3월에 Cont., C15 처리구가 각각 0.24, 19.22 ds/m로 약 80배 가량 차이가 났으나 7월에는 점점 그 격차가 좁아졌다. 또한 Cont., C1, C2, C5는 3월에 비해 7월의 전기전도도가 높아졌으나 C10, C15 처리구는 감소하였다. 페페로미아의 경우, 금사철과 비슷하게 3월과 7월의 결과치가 교차되나 7월경 C15 처리구 역시 14.26 ds/m으로 전기전도도가 비교적 높았으며, 타 실험구와도 큰 차이를 나타냈다. 전기전도도는 이온과 염의 농도를 알 수 있는 지표로 염분의 처리농도가 높아지면서 이온들의 함량이 높아져 전기전도도가 증가한다는 것을 알 수 있다(Ju et al., 2019). 특히 염화칼슘 (CaCl2) 내 염소이온은 나트륨(Na+)와 달리 식물에 있어 주요 영양소로 수소이온(H+)과 동반하여 세포 내로 이동하는데 염분에 대한 식물의 반응은 복잡하지만 배지 내 이온이 증가하는 기작을 포함한다는 것을 고려해볼 때(Isayenkov and Maathuis, 2019), 염분농도가 높아질수록 염소이온 또한 함께 증가하여 식물의 생육에 부정적 영향을 끼칠 수 있음을 시사한다고 하겠다. 식물별 적정 EC의 범위를 벗어나면 지상부로의 양분 및 수분 흡수에 제한 인자로 작용하여 염분농도가 높아질수록 무기성분의 균형이 흐트러지고 일부 원소들의 과잉 집적 또는 부족으로(Yu and Bae, 2005) 생육장해를 일으킬 것으로 예상된다.
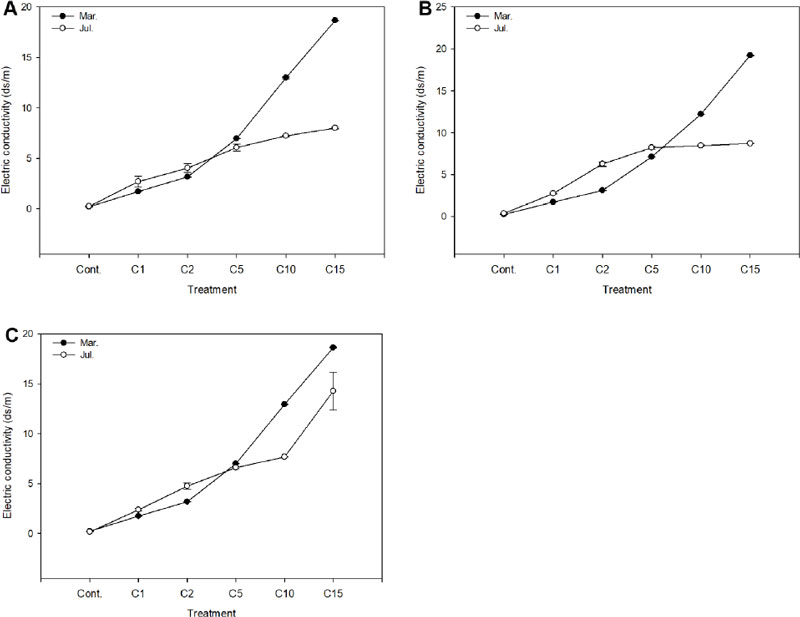
Change of electrical conductivity (EC) in solution grown Euonymus japonicus (A), Hedera helix (B), and Peperomia puteolata (C) for a period March (●) and July (○) months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture. Vertical bars represent ± standard error (n = 9). Calcium chloride (CaCl2) were added to the solution to prepare the saline solution. Cont: non-treatment, C1, C2, C5, C10, and C15: CaCl2 1, 2, 5, 10, and 15 g·L-1, respectively.
3.2. 염분농도 처리에 따른 생육 반응
염화칼슘 처리 후 실험종료 시점인 7월에 금사철, 아이비, 페페로미아의 생존율을 살펴본 결과는 다음과 같다(Table 1). 페페로미아는 대조구, C1, C2, C5, C10 처리구가 각각 100, 100, 90, 90, 30%인 반면, 아이비는 대조구, C1, C2, C5 처리구에서 각각 100, 90, 40, 70%로 C5 처리구에서 비교적 낮은 농도인 C2보다 생존율이 높게 나타났다. 같은 농도의 처리에서 금사철은 Cont., C1, C2 처리구만 생존하였고, 생존율은 각각 30, 80, 50%로 조사되었다(Table 1). 이에 금사철은 수경재배 시 2 g·L-1, 아이비는 5 g·L-1, 페페로미아는 10 g·L-1 이하의 염화칼슘 처리에서 생존이 가능하여 페페로미아가 다른 두 가지 관엽식물에 비해 좀 더 고농도에서 생육이 가능하다는 것을 알 수 있다.

Survival rate (%) of three indoor foliage plant species exposed for 4 months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture
금사철의 생장지수는 생장이 시작되는 3월부터 4월까지 염분 스트레스의 영향으로 대조구를 제외하고 감소하다가 비교적 고농도 처리구인 C5, C10, C15는 고사하였다. 이는 실험종료시점 폭염 등 환경적인 요인과 함께 물재배 시 나타날 수 있는 부영양화, 미생물 증식, 이끼 증가 등 녹조류 피해로 인한 것으로 보인다(Jeon et al., 2021). C1 처리구는 4월 이후 생장지수가 꾸준히 상승하였으며, 7월에는 C1, C2, Cont.구가 각각 6.7, 3.9, 3.2로 조사되었다. 아이비의 경우, 가장 고농도인 C15 처리구를 제외하고 5월까지 생장지수가 꾸준히 증가하였으나 C15는 5월, C10은 6월부터 감소하며 고사하였다. 실험 종료 시점인 7월에는 생장지수가 Cont. > C1 > C5 > C2의 순으로 높았는데 다른 2종의 공시식물에 비해 대조구에서 18.3로 생장지수가 현저히 높았다. 또한, C5, C2 처리구가 각각 7.9, 5.6로 보다 고농도인 C5 처리구의 생육지수가 더 양호한 것으로 나타났다. 아이비는 대표적인 실내식물로 배지재배에 비해 수경재배 시 생육 증가량이 높고, 무기성분 중 Ca 함량 역시 수경재배에서 가장 높았다는 것을 고려해 볼 때(Jang et al., 2009), 이온화된 칼슘이 잎으로 이동한 것으로 사료된다. 페페로미아는 4월까지 농도가 높은 C10, C15 처리구가 염분스트레스로 생장지수가 감소하다가 C10 처리구에서 6월 이후 상승하였다. 7월에는 C2, C1, Cont., C5, C10 처리구가 각각 12.1, 11.0, 10.5, 10.1, 3.1로 C1, C5는 대조구와도 유의적인 차이를 보이지 않는 범위에서 5월 이후 지속적으로 상승하여 염분농도의 영향을 거의 받지 않는 것으로 나타났다. 아이비를 제외한 금사철, 페페로미아는 실험종료시점 C1, C2 처리구가 대조구보다 생장지수가 높았으며 페페로미아는 C2 처리구가 C1에 비해 오히려 상승하였다(Fig. 3). 이는 페페로미아가 다육질의 잎을 가지고 있어, 엽내 water regime로 지속적인 염분 스트레스 노출 시 덜 민감한 수종인 것으로 판단된다(Barbafieri et al., 2023). 더불어, 식물 세포질 내 Ca2+ 농도는 높은 염분, 추위 및 가뭄을 비롯한 비생물적 스트레스와 같은 많은 생리적 자극에 반응하여 증가하며, 칼슘 이온은 조직의 성장을 촉진하여 염 중독을 줄이는 데 기여한다(Tuteja and Mahajan, 2007). 이에 실내 물재배 시 수원을 수돗물 또는 중수도로 공급할 경우, 내염성 높은 수종 식재 외에 배지 내 화학적 메커니즘을 적용한 다공성 매질 또는 무기질계 토양개량제의 첨가로 염류장애를 최소화하기 위한 관리기법이 필요하다고 생각된다.
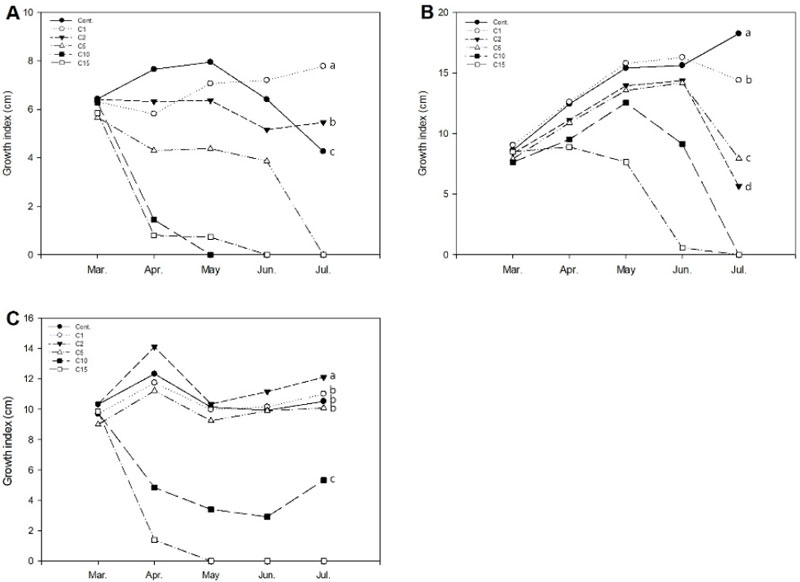
Change of growth index of Euonymus japonicus (A), Hedera helix (B), and Peperomia puteolata (C) for a period 4 months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture. Final growth index among the salt concentrations followed by different letters indicates significant difference by Duncan’s multiple range test at p < 0.05. Calcium chloride (CaCl2) were added to the solution to prepare the saline solution. Cont: non-treatment, C1, C2, C5, C10, and C15: CaCl2 1, 2, 5, 10, and 15 g·L-1, respectively.
금사철의 엽폭은 C1(15.80 mm), C2(8.90 mm), Cont.(4.86 mm) 순이며, 엽장과 엽수 또한 C1, C2, Cont..구의 순으로 길어, 염분처리구가 대조구에 비해 잎의 생장이 높은 것으로 나타났다. 반면, 아이비는 실험종료 시점에 대부분의 실험구에서 엽장과 엽폭 모두 감소하는 경향이었다. 특히 실험 초반과 비교하여 대조구에 비해 C1, C5, C2 처리구가 크게 줄어들었는데 엽폭은 약 16%-44%, 엽장은 약 16%-53%로 감소하였다. 엽수의 경우 염화칼슘 농도가 높아질수록 감소하였다. 또한 C1 처리구는 엽폭, 엽장, 엽수에서 대조구와 유의적인 차이를 보이지 않았고, 실험 종료 시점인 7월경 아이비의 엽장, 엽폭 모두에서 C5가 C2 처리구에 비해 더 높은 것으로 보아 금사철에 비해 아이비가 염화칼슘 처리에 있어 한계농도가 높은 것으로 판단된다. 페페로미아의 경우, C10 처리구를 제외한 C1, C2, C5 처리구의 잎의 변화가 실험기간동안 비슷하였으며 C2, C1 처리구는 각각 19.00, 18.13 mm로 대조구보다 큰 엽폭을 보였다. 엽장은 C2(27.89 mm) > C1(27.51 mm) > Cont.(26.47 mm) > C5(22.71 mm) > C10(8.5 mm) 순으로 나타났으며, C15 처리구는 고사하였다. 엽수는 7월경 C5, C2, Cont, C1, C10의 순으로 많았는데 특히 C5 처리구는 엽장, 엽폭에서는 대조구보다 낮았으나 실험기간 동안 지속적으로 증가하여 실험 종료 시점 가장 많은 엽수가 관찰되었다(Table 2). 실제로 염 스트레스를 받은 잎에 있어 염화칼슘은 항산화 효소를 활성화하여 스트레스를 완화할 수 있으며(Khan et al., 2012), Kadir(2005)는 염화칼슘 엽면 시비에 따라 무기성분 균형에 변화를 주었으며, 칼슘(Ca) 성분이 무게, 크기, 모양 등 수확 시 과일 품질을 향상시켰다고 보고하였다.

Leaf width, leaf length, and number of leaves of three indoor foliage plant species exposed for 4 months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture
금사철의 상대엽록소함량은 C1, Cont., C2 처리구에서 각각 22.97, 15.48, 7.85 SPAD-value로, C1 처리구는 유의적 차이를 보이며, 대조구보다 높게 나타났다. 또한 3월-4월 사이에 Cont..을 제외한 모든 염화칼슘 처리구에서 저하되는 양상이었는데 C1, C2 처리구는 약 10% 떨어진 반면 C5-C15 처리구는 약 39.7%-87.6%로 고농도의 실험군일수록 큰 폭으로 감소하였다. 이는 과도한 염류 집적으로 삼투압이 증가하여 수분 흡수가 저해되었으며, 특정 이온의 비정상적인 흡수로 나타나는 염 스트레스로(Kim et al., 2019) 비교적 고농도 처리구인 C5, C10, C15 처리구는 고사한 것으로 판단된다. 토양의 무기영양물질은 토양용액 중의 수용성 이온형태로 작물체내 공급되는데 염소이온(Cl-)은 식물에 흡수되어 각각 단백질 합성, 산화화원반응 등에 관여, 광합성에 관여하는 필수성분으로 결핍 또는 과잉 존재할 경우 작물의 생육에 부정적인 영향을 미친다(Lee et al., 2020). 특히 CaCl2는 NaCl보다 단위중량당 염소를 더 많이 포함하고 있어 식물체내 보다 많은 염이온이 축적되어 독성농도에 이르면 세포내 영양소의 균형 파괴로 전체 식물체가 고사하는 것으로 사료된다(Shin et al., 2010). 아이비는 C1 > Cont. > C5 > C2의 순으로 상대엽록소함량이 많았는데 C1 처리구는 대조구보다 높았으며, Cont.과 C5는 각각 11.60, 11.49로 통계상 유의적인 차이가 나타나지 않았다. 또한 대조구를 포함하여 상대엽록소함량이 전반적으로 급격히 감소하는 경향이었다. 페페로미아의 상대엽록소함량은 C5, C2, C1 처리구가 대조구에 비해 높은 21.34, 19.99, 17.46 SPAD-value로 C2, C1 처리구는 실험기간 내내 대조구보다 높은 상대엽록소함량을 보였다. 또한 C5, C1 처리구는 5월경 상대엽록소함량이 상승하였다가 다른 실험구와 함께 낮아졌는데 C5 처리구의 감소폭이 C1 처리구에 비해 적었다(Fig. 4). 염소이온은 식물의 삼투압 조절, 광합성 등에 필수적인 영양소임과 동시에 염해지 식물독성에 가장 큰 영향을 미치는 음이온으로 알려져 있으나 내염성 수종의 경우, 삼투물질의 축적을 개선하고, 이온균형의 항상성을 유지함으로써 염분 스트레스에 대한 식물체 내 내성을 강화한다(Khan et al., 2012). 또한 염에 민감한 수종에 비해 광합성률이 높고 염소이온(Cl-)이 잎으로 흡수되는 양이 상대적으로 적다는 것을 고려해볼 때(Ashraf and Bashir, 2003), 페페로미아는 금사철과 아이비보다는 염소이온에 대해 덜 예민함을 알 수 있다.
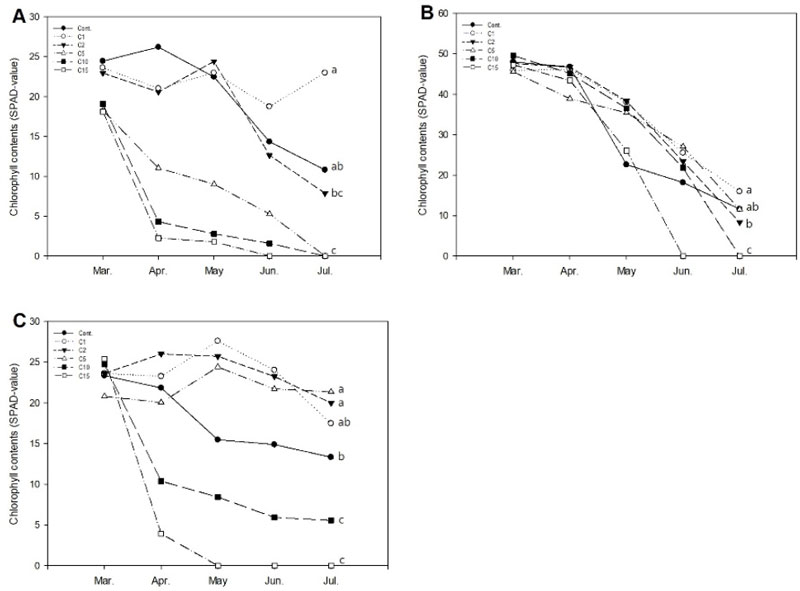
Change of relative chlorophyll contents of Euonymus japonicus (A), Hedera helix (B), and Peperomia puteolata (C) for a period 4 months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture. Final chlorophyll contents among the salt concentrations followed by different letters indicates significant difference by Duncan’s multiple range test at p < 0.05. Calcium chloride (CaCl2) were added to the solution to prepare the saline solution. Cont: non-treatment, C1, C2, C5, C10, and C15: CaCl2 1, 2, 5, 10, and 15 g·L-1, respectively.
염화칼슘 처리농도에 따른 지상부와 지하부의 생체중을 살펴본 결과, 금사철의 지상부 생체중은 처리농도가 높아질수록 감소하였다. 염 스트레스는 식물의 생장 저해를 가져오며, 염소이온은 식물의 잎과 지상부에서 가장 높은 농도로 나타난다(Tunçtürk et al., 2011). 지하부 생체중의 경우 C10을 제외하고 처리농도에 반비례하는 경향이었다. 아이비의 지상부 생체중은 Cont., C1, C5, C2, C10, C15의 순으로 각각 4.01, 1.66, 1.13, 0.98, 0.51, 0.38 g였으며, C2보다 C5 처리구가 더 무거웠으나 유의적인 차이는 보이지 않았다. 지하부는 Cont. (3.40 g), C1 (1.27 g), C5 (0.46 g), C2 (0.44 g), C15 (0.41 g), C10 (0.25 g)의 순으로 크게 나타났으며, 2 g 이상의 염화칼슘 처리구의 지하부 생체중은 1 g이하로 C2, C5, C15 처리구간 유의적인 차이는 없었다. 페페로미아는 금사철과 아이비에 비해 지상부와 지하부 모두 생체중이 확연히 높게 나타났다. 지상부 생체중은 처리농도별로 무겁게 나타났으며, 비교적 고농도인 C10, C15 처리구에서 생체중이 다른 실험구에 비해 급격히 낮아졌다. 지하부에서는 Cont., C1, C2, C5, C15, C10 처리구의 순으로 가벼웠으나 대조구를 제외하고 처리구별 유의적인 차이가 나타나지 않았다(Fig. 5).
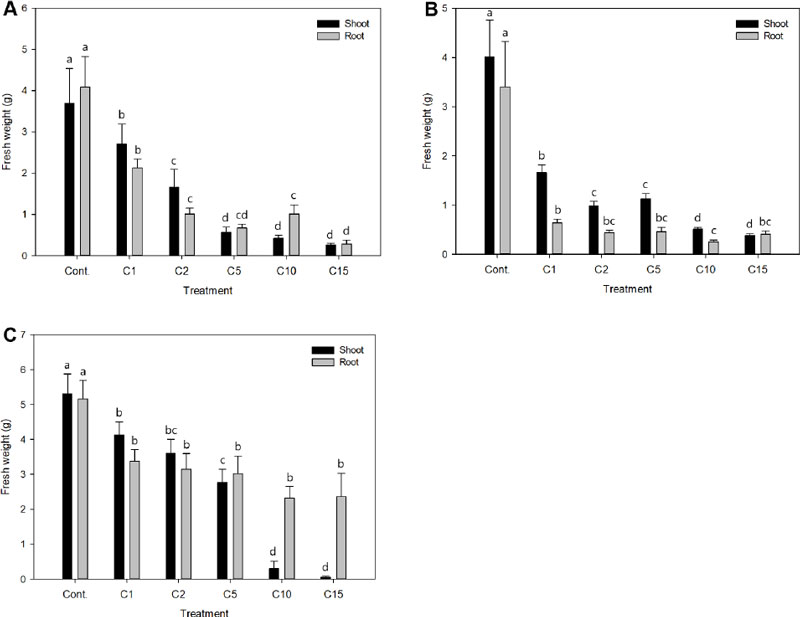
Shoot (■) and root (□) fresh weight of Euonymus japonicus (A), Hedera helix (B), and Peperomia puteolata (C) for a period 4 months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture. Vertical bars represent ± standard error (n = 9). The different letters above column bars within treatments letters indicates significant difference by Duncan’s multiple range test at p < 0.05. Calcium chloride (CaCl2) were added to the solution to prepare the saline solution. Cont: non-treatment, C1, C2, C5, C10, and C15: CaCl2 1, 2, 5, 10, and 15 g·L-1, respectively.
생체중과 건물중으로 각 식물체 내의 건물률 분석 결과, 금사철은 C15, C5, C10, C1, C2, Cont.의 순으로 대조구와 함께 C1, C2는 낮은 건물률을 보였고, C15가 약 74%로 가장 크게 나타났다. 한편 아이비는 C10, C2, C15, C5, C1, Cont.의 순으로 높았는데 대조구는 약 12%로 가장 낮았고, 염화칼슘 처리구는 농도에 상관없이 37%-50%로 높은 건물률을 보였다. 페페로미아의 경우 C5, C10, C2, C1, C15, Cont.이 각각 14.3, 13.4, 10.4, 9.9, 9.1, 7.8%로 다른 공시 식물에 비해 건물률이 확연히 낮았으며, 처리농도별 뚜렷한 차이를 보이지 않았다. Sung et al.(2009)은 CaCl2의 처리에 따라 산딸나무의 광합성 속도 및 기공전도도의 감소를 지적하며, 고농도 이온의 식물체내 축적은 식물체 내외적으로의 수분이동을 제한한다고 보고하였다. 건조 스트레스는 작물의 생존과 생산성을 결정하는데 매우 중요한 환경요인으로(Yu and Park, 2015), 이러한 결과는 염분 스트레스 하에서 잎의 Ca2+ 함량과 함께 엽수, 식물 성장의 감소를 초래하는 것으로 나타났다(Lolaei, 2012). 본 연구는 실내 관엽식물을 대상으로 염분 처리농도에 따른 배지환경 및 식물생육을 살펴보았기 때문에 수용액 및 식물체 내 영향을 주는 다양한 무기이온 특정과 함량 및 영양요구도에 대한 추가 실험이 필요할 것으로 생각된다. 따라서 향후 장기적인 물재배 시 다양한 수종과 배지환경에서의 생육 모니터링 등 보다 복합적인 연구가 필요하다고 본다.
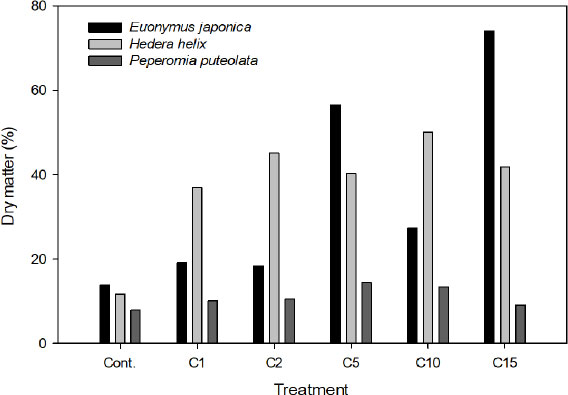
Dry matter (%) of Euonymus japonicus (A), Hedera helix (B), and Peperomia puteolata (C) for a period 4 months to increasing salts (CaCl2) concentrations in a greenhouse hydroculture. Calcium chloride (CaCl2) were added to the solution to prepare the saline solution. Cont: non-treatment, C1, C2, C5, C10, and C15: CaCl2 1, 2, 5, 10, and 15 g·L-1, respectively.
4. 결 론
본 연구는 염분농도를 다르게 처리하여 3가지 실내 관엽식물인 금사철(Euonymus japonicus), 아이비(Hedera helix 및) 및 페페로미아(Peperomia puteolata)의 수용액 환경변화 및 내염성을 평가하기 위해 수행되었다. 염분처리로 염화칼슘(CaCl2)를 사용하여 6가지 농도(Cont., C1, C2, C5, C10 및 C15로 지칭되는 0, 1, 2, 5, 10 및 15 g·L-1)를 3종의 관엽식물 배지 수용액에 각각 4개월간 처리하였다. 조사항목으로는 수용액의 산도와 전기전도도, 식물의 생존율, 생장지수, 초장, 초폭, 엽장, 엽폭, 엽수, 생체중, 건물중, 건물률, 상대엽록소함량 등을 조사하였다. 염분농도 처리에 따라 초기 중성-염기성이었던 수용액이 산성화되었으며, 전기전도도는 처리농도에 비례하여 높아지는 경향을 보였다. 생존율은 금사철, 아이비, 페페로미아에서 염분 처리농도별 각각 C2, C5, C10의 농도까지 생존하였으며 가장 고농도 처리구인 C15는 고사하였다. 금사철의 경우 엽폭, 엽장, 엽수 모두 C1 > C2 > Cont.구의 순으로, 아이비는 엽장, 엽폭에서 Cont. > C1 > C5 > C2 처리구의 순으로 높게 나타났다. 페페로미아는 다른 처리구에 비해 염분농도 10 g·L-1 이상에서 엽폭, 엽장, 엽수의 감소현상이 뚜렷하였다. 상대엽록소함량에서 금사철과 아이비는 C1 처리구가, 페페로미아는 C5, C2, C1 처리구가 대조구보다 높은 수치를 보인 한편 아이비는 C5 처리구와 대조구간 유의적인 차이를 보이지 않았다. 지상부 생체중은 염분 처리농도에 비례하여 무거웠는데 특히 페페로미아는 금사철과 아이비에 비해 지상부와 지하부 모두 생체중이 확연히 높게 나타났다. 건물률 분석 결과, 금사철, 아이비, 페페로미아 모두 대조구에서 가장 낮았으며, 금사철은 C15 처리구가 74%, 아이비는 염분농도에 상관없이 약 37%-50%, 페페로미아의 경우 약 9%-14%로 다른 공시 식물에 비해 확연히 낮은 건물률을 보였다. 따라서 실내 물재배에서 금사철, 아이비, 페페로미아의 염분이 각각 2, 5, 10 g·L-1 이하가 한계농도로, 그 이상의 배지환경은 생육에 부정적인 영향을 줄 수 있음을 시사한다. 따라서, 이러한 결과는 물재배 뿐 아니라 대규모의 실내녹화 조성 시 적합한 수종 선정 및 수분환경에 대한 장기적 유지관리 지침을 제안할 수 있다. 그럼에도 불구하고, 식물의 생육 및 녹화에 있어 근권 환경은 매우 중요한 요소로 추후 염분축적에 따른 다양한 실내 수종별 내염성 평가 및 제염 및 염분상승 차단 기술에 대한 연구가 면밀하게 이루어져야 한다고 본다.
Acknowledgments
이 논문은 2023년도 건국대학교 KU 학술연구비 지원에 의한 결과입니다.
References
-
Ashraf, M., Bashir, A., 2003, Salt stress induced changes in some organic metabolites and ionic relations in nodules and other plant parts of two crop legumes differing in salt tolerance, Flora: Morpho. Distrib. Funct. Ecol. Plants, 198, 486-498.
[https://doi.org/10.1078/0367-2530-00121]

-
Barbafieri, M., Bretzel, F., Scartazza, A., Baccio, D. D., Rosellini, I., Grifoni, M., Pini, R., Clementi, A., Franchi, E., 2023, Response to hypersalinity of four halophytes growing in hydroponic floating systems: prospects in the phytomanagement of high saline wastewaters and extreme environments, Plants, 12, 1737.
[https://doi.org/10.3390/plants12091737]

-
Clapa, D., Fira, A., Joshee, N., 2013, An Efficient ex vitro rooting and acclimatization method for horticultural plants using float hydroculture, Hortscience, 48, 1159-1167.
[https://doi.org/10.21273/HORTSCI.48.9.1159]

-
Furlani, A. M. C., de Abreu, M. F., de Abreu, C. A., Furlani, P. R., Bataglia. O. C., 2004, November. Determination of available macronutrients, Na, Cl, pH and EC in coir substrate incubated with mineral fertilizers, In International Symposium on Soilless Culture and Hydroponics, 697, 109-115.
[https://doi.org/10.17660/ActaHortic.2005.697.12]

-
Garcı́a-Sánchez, F., Jifon, J. L., Carvajal, M., Syvertsen, J. P., 2002, Gas exchange, chlorophyll and nutrient contents in relation to Na+ and Cl− accumulation in ‘Sunburst’mandarin grafted on different rootstocks, Plant Sci., 162, 705-712.
[https://doi.org/10.1016/S0168-9452(02)00010-9]

-
Hammond, H. E., Norcini, J. G., Wilson, S. B., Schoellhorn, R. K., Miller, D. L., 2007, Growth, flowering, and survival of firewheel (Gaillardia pulchella foug.) based on seed source and growing location, Native Plants Journal, 8, 25-39.
[https://doi.org/10.2979/NPJ.2007.8.1.25]

-
Isayenkov, S. V., Maathuis, F. J., 2019, Plant salinity stress: many unanswered questions remain, Front. Plant. Sci., 10, 80.
[https://doi.org/10.3389/fpls.2019.00080]

- Jang, H. S., Lee, S. G., Moon, J. H., Pak, C. H., 2009, Effect of applied substrates on foliage growth in hydro-culture, J. Bio-Env. Con., 18, 460-467.
-
Jang, T. J., Kim, H. Y., Lim, K. B., 2013, Selection of artificial media suitable for the growth of foliage plants for indoor vertical garden, Flower Res. J., 21, 11-16.
[https://doi.org/10.11623/frj.2013.21.1.1]

-
Jeon, S. Y., Sung, J. M., Baek, S. H., Kwon, K. H., 2021 Growth changes and antioxidant activities of Romaine lettuce with plasma discharge water and bioblock treatment, Korean J. Food Preserv., 28, 356-363.
[https://doi.org/10.11002/kjfp.2021.28.3.356]

-
Jeong, J. H., Kim, T. K., Choi, W. Y., Kim, S., Baek, N. H., Yang, C. H., Kim, D. H., Kim, Y. D., Lee, S. B., Lee, K. B., Park, K. H., Cho, K. M., 2013, Optimum salinity concentration and nitrogen fertilization for Salicornia herbaecea growth in reclaimed land, J. Korean Soc. Int. Agri., 25, 62-67.
[https://doi.org/10.12719/KSIA.2013.25.1.062]

-
Ju, J. H., Son, H. M., Kim, W. T., Yoon, Y. H., 2019, Effects of activated carbon on growth and physical responses of indoor plant Dracaena braunii to alleviate salt-induced stress in water culture., J. Environ. Sci. Int., 28, 321-328.
[https://doi.org/10.5322/JESI.2019.28.3.321]

-
Ju, J. H., Yang, J., Park, S. Y., Yoon, Y. H., 2019, Assessing effects of calcium chloride (CaCl2) deicing salt on salt tolerance of Miscanthus sinensis and leachate characterizations, Journal of Korean Institute of Landscape Architecture, 47, 61-67.
[https://doi.org/10.9715/KILA.2019.47.4.061]

-
Kadir, S. A., 2005, Fruit quality at harvest of “Jonathan” apple treated with foliarly-applied calcium chloride, J. Plant Nutr., 27, 1991-2006.
[https://doi.org/10.1081/PLN-200030102]

-
Khan, M. N., Siddiqui, M. H., Mohammad, F., Naeem. M., 2012, Interactive role of nitric oxide and calcium chloride in enhancing tolerance to salt stress, Nitric. Oxide., 27, 210-218.
[https://doi.org/10.1016/j.niox.2012.07.005]

-
Kim, J. A., Choo, Y. S., Lee, I. J., Bae, J. J., Kim, I. S., Choo, B. H., Song, S. D., 2002, Adaptations and physiological characteristics of three chenopodiaceae species under saline environments, Korean J. Ecology and Environment, 25, 101-107.
[https://doi.org/10.5141/JEFB.2002.25.2.101]

- Kim, J. Y., Seong, P. M., Lee, D. B., Chung, N. J., 2019, Growth and physiological characteristics in a halophyte Suaeda glauca under different NaCl concentrations, Korean Journal Crop Science, 64, 48-54.
- Kim, S. T., Yoo, S. J., Song, J., Weon, H. Y., Sang, M. K., 2020, Effect of Trichoderma sp. GL02 on alleviating drought stress in pepper plants, Korean J. Org. Agri., 28, 417-430.
-
Kwack, Y., Park, S. W., Chun, C., 2014, Growth and development of grafted cucumber transplants as affected by seedling ages of scions and rootstocks and light intensity during their cultivation in a closed production system, Hortic. Sci. Technol., 32, 600-606.
[https://doi.org/10.7235/hort.2014.14039]

- Lee, H. J., Yang, E. Y., Park, K. S., Lee, Y. B., Bae, J. H., Jeon, K. S., 2004, Effect of EC and pH of nutrient solution on the growth and quality of single-stemmed rose in cutted rose production factory., J. Bio-Env. Con., 13, 258-265.
-
Lee, J. M., Park, S. Y., Yoon, Y. H., Ju, J. H., 2020, Seasonal variations of de-icing salt ions harvested from soils and plants according to the salt damage of Pinus densiflora f. multicaulis on Roadsides, J. Environ. Sci. Int., 29, 395-402.
[https://doi.org/10.5322/JESI.2020.29.4.395]

- Lolaei, A., 2012, Effect of calcium chloride on growth and yield of tomato under sodium chloride stress, Journal of Ornamental Plants, 2, 155-160.
-
Loudari, A., Benadis, C., Naciri, R., Soulaimani, A., Zeroual, Y., Gharous, M. E., Kalaji, H. M., Oukarroum, A., 2020, Salt stress affects mineral nutrition in shoots and roots and chlorophyll a fluorescence of tomato plants grown in hydroponic culture, J. Plant Interact., 15, 398-405.
[https://doi.org/10.1080/17429145.2020.1841842]

- Shim, M. S., Kwon, O. K., 2010, Growth responses of various ornamental foliage plants to nutrient solution strength, J. Bio-Env. Con., 19, 210-216.
- Shin, S. S., Park, S. D., Kim, H. S., Lee, K. S., 2010, Effects of calcium chloride and eco-friendly deicer on the plant growth, J. Korean Soc. Enviro. Eng., 32, 487-498.
- Shrestha, A., Dunn, B., 2010, Hydroponics, Oklahoma Cooperative Extension Service, Oklahoma State University.
-
Sung, J. H., Je, S. M., Kim, S. H., Kim, Y. K., 2009, Effect of calcium chloride (CaCl2) on the characteristics of photosynthetic apparatus, stomatal conductance, and fluorescence image of the leaves of Cornus kousa, Korean J. Agric. For. Meteorol., 11, 143-150.
[https://doi.org/10.5532/KJAFM.2009.11.4.143]

- Tunçtürk, M., Tunçtürk, R., Yildirim, B., Çiftçi, V., 2011, Effect of salinity stress on plant fresh weight and nutrient composition of some Canola (Brassica napus L.) cultivars, Afr. J. Biotechnol., 10, 1827-1832.
-
Tuteja, N., Mahajan, S., 2007, Calcium signaling network in plants: an overview, Plant Signal Behav., 2, 9-85.
[https://doi.org/10.4161/psb.2.2.4176]

-
Yang, J., Park, J. H., Yoon, Y. H., Ju, J. H., 2020 Comparison of the high concentration calcium chloride (CaCl2) salt reduction effect of soil amendment agent and planting Pennisetum alopecuroides, Korean J. Environ. Ecol., 34, 345-354.
[https://doi.org/10.13047/KJEE.2020.34.4.345]

-
Yu, J. G., Park, Y. D., 2015, Isolation and functional identification of BrDSR, A New gene related to drought tolerance derived from brassica rapa, Hortic. Sci. Technol., 33, 575-584.
[https://doi.org/10.7235/hort.2015.15056]

- Yu, S. O., Bae, J. H., 2005, Development of optimal nutrient solution of tomato (Lycopercicon esculentum Mill.) in a closed soilless culture system, J. Bio-Env. Con., 14, 203-211.
Department of Green Technology Convergence, College of Science & Technology, Konkuk Universityjjhkkc@kku.ac.kr
Department of Green Technology Convergence, College of Science & Technology, Konkuk Universitywripark@naver.com
Department of Green Technology Convergence, College of Science & Technology, Konkuk Universityyonghan7204@kku.ac.kr