금강유역 신규조성습지의 환경 특성이 동물플랑크톤 군집 구조에 미치는 영향
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The newly created wetlands in the Geum River Basin have undergone various environmental changes since their establishment in 2012. In this study, we evaluated the influence of environmental characteristics on zooplankton, which are sensitive to environmental changes, and considered appropriate wetland management plans. The thirty-two wetlands were divided into two groups based on the differences in their macrophyte cover. High species diversity and zooplankton density were found in cluster 2, which had abundant macrophyte cover. In contrast, cluster 1, with low plant cover, had lower species diversity and zooplankton density, primarily of pelagic zooplankton. To maintain species diversity and abundance of zooplankton in wetlands, we recommend implementing a management strategy that encourages the development of various plant communities through efficient water conveyance functions.
Keywords:
Environmental variables, Macrophytes cover, Biodiversity, Epiphytic, Wetland management, Cluster analysis1. 서 론
담수생태계에서 동물플랑크톤 군집은 서식환경 변화에 따라 민감하게 반응하는 생물 군집이다(Dallas and Drake, 2014). 동물플랑크톤 군집은 물의 흐름에 저항하여 이동할 만큼 유영능력이 뛰어나지 못하기 때문에 환경의 급격한 변화는 이들의 생존 가능성을 낮추고 개체군 성장을 방해하는 요인이 될 수 있다(Seuront et al., 2004). 특히, 습지나 하천에서 발생하는 유량과 수위 증가는 동물플랑크톤 종조성과 군집 구조에 부정적인 영향을 미치는 요인이다(Flinn et al., 2005). 한국을 포함한 동아시아 지역은 몬순(monsoon) 기후의 영향으로 여름철에 강우가 집중되기 때문에 이 시기에 봄철에 성장하였던 동물플랑크톤 군집의 밀도는 급격하게 감소한다(Choi et al., 2011). 강우뿐만 아니라 수온이나 용존산소와 같은 이화학적 요인 또한 동물플랑크톤의 종조성과 군집 구조에 영향을 미쳤다. 높은 수온은 동물플랑크톤 개체의 물질대사를 가속화하여 이들의 번식과 개체군 증가에 영향을 미치며(Zhao et al., 2020), 호수에서 용존산소의 수직적 변화는 포식자를 회피하기 위한 방어 전략을 구사하게 하였다(Scofield et al., 2020). 한국과 같이 수온의 계절 변화가 뚜렷한 지역에서 동물플랑크톤 군집은 봄철부터 증가하는 개체군 성장 곡선을 가지다가, 여름철에 강우에 의한 영향을 받으며, 다시 증가된 동물플랑크톤 밀도는 늦은 가을부터 감소하는 경향을 보인다(Choi et al., 2020a). 탁도나 엽록소-a 농도 또한 동물플랑크톤의 여과 섭식률을 결정하는 요인으로 동물플랑크톤 군집 구조에 분명한 영향을 미친다(Wojtal-Frankiewicz and Frankiewicz, 2011; Chen and Chen, 2017). 동물플랑크톤은 수생태계 먹이망 내에서 식물플랑크톤을 소비하며, 어류와 같은 상위 포식자의 주요 먹이원으로 활용되기 때문에, 이들의 종조성과 군집 분포는 수생태 먹이망의 구조에 뚜렷한 영향을 미칠 수 있다(Bunn and Boon, 1993). 따라서, 다양한 환경 변화에 대한 동물플랑크톤 군집의 종조성과 군집 구조를 파악하는 것은 수생태계의 기능을 이해하기 위해 중요한 정보로 활용될 수 있다.
이와 같은 중요성으로 인해, 동물플랑크톤 군집 구조에 대한 연구는 하천, 호소, 그리고 습지 등의 다양한 담수생태계에서 지속적으로 수행되었다. 하천생태계에서 동물플랑크톤 군집은 흐름과 유량 변화와 같은 교란과 관련된 연구가 수행되었으며(Zhao et al., 2013; Portinho et al., 2016), 호소나 습지에서는 수생식물의 서식처 및 피난처로서 역할과 효과에 대해 주로 연구되었다(Manatunge et al., 2000; Horppila et al., 2009). 최근에는 하천이나 습지생태계를 구성하는 먹이 사슬과 구성인자간 상호관계(포식자-피식자 관계 등)를 안정동위원소 분석(stable isotope analysis) 등의 화학적 분석을 통해 규명하여 '생물다양성의 증가를 위한 지속적 관리 측면'에서 연구가 활발하게 수행되고 있다(Choi et al., 2014; Kattel et al., 2020; Blechinger et al., 2024).
담수생태계에서 출현하는 동물플랑크톤은 종(species)에 따라 선호하는 환경과 먹이원 등이 다르게 나타나기 때문에 서식처의 종류 및 특성에 따라 종조성과 군집 구조가 상이하다(Vincent et al., 2012). 한국은 계절성이 강하고 산간 지역이 많아 독특한 서식환경을 가진 수체가 산재해 있는 특징을 가지기 때문에 다양한 동물플랑크톤 종이 분포할 수 있다(Ji et al., 2022). 특히, 습지의 경우 수심이 얕고 정체된 수역이 형성되는 지역으로 다양한 수생식물이 피복되기 용이하다. 습지는 수심이 깊고, 인공불투수성의 호안부가 발달한 저수지나 댐과 분명하게 구분된다. 습지에 서식하는 동물플랑크톤은 수생식물과 밀접한 관련성을 가진다(Gutierrez et al., 2022). 수생식물에 의해 피복된 공간은 다른 공간보다 복잡한 구조를 가지기 때문에 식물의 잎과 줄기에 동물플랑크톤이 부착하거나, 포식자를 회피하기 위한 피난처로서 활용될 수 있다(Lomartire et al., 2021). 수생식물이 부재한 호수/저수지와 수생식물이 풍부한 습지간에 동물플랑크톤 종조성의 차이는 부착 성향을 가진 동물플랑크톤 종의 분포 여부이며, 이는 수생식물의 풍부함에 따라 분명하게 달라지는 요인이다(Kim et al., 2022b). 따라서, 동물플랑크톤 군집을 부착성과 부유성으로 구분하여 종조성과 군집 구조를 분석하는 것은 담수 환경의 특성과 현 상태를 파악하기 위한 지표로서 활용할 수 있다.
금강은 진안군, 무주군, 금산군 등을 관류하여 군산으로 빠져나가는 국내에서 세 번째로 큰 규모를 가진 강이다(유역면적, 9,912.14 km2; Im et al., 2020). 금강은 상류 구간에 위치한 용담댐, 중·하류구간에 대청댐, 그리고, 중·하류 구간에 세종보, 공주보, 그리고 백제보에 의해 물 흐름이 인위적으로 조절되며, 유량이 높아지는 일부 시기를 제외한 대부분은 정체된 수역을 형성한다(Lee et al., 2020; Kim et al., 2022a). 금강은 2012년에 실시된 ‘하천정비사업’으로 인해 둔치와 홍수터 공간은 공원화되었으며, 수변부에 인위적인 변화가 발생하면서 32개의 습지가 인위적으로 조성되었다. 이 습지들은 기존 습지의 훼손된 면적을 대체하는 목적으로 조성되었지만, 생태학적 측면보다는 경관적인 측면을 기반으로 설계되었기 때문에 생물이 안정적으로 분포하기에 어려운 환경 특성을 가진다. 본 연구에서는 금강 유역에 위치한 신규조성습지의 환경 특성이 동물플랑크톤 군집의 종조성과 군집 구조에 미치는 영향을 분석하였으며, 이를 기반으로 동물플랑크톤 군집의 밀도와 다양성 확보를 위한 습지의 관리전략을 마련하였다. 동물플랑크톤 군집은 종에 따라 다양한 서식 형태를 가지므로, 환경적 특성에 대한 영향이 매우 분명할 것으로 판단된다. 이 결과는 추후 신규조성습지를 개선하거나 지속적으로 관리를 위한 기초 자료로 활용될 수 있다.
2. 연구방법
2.1. 조사지 현황
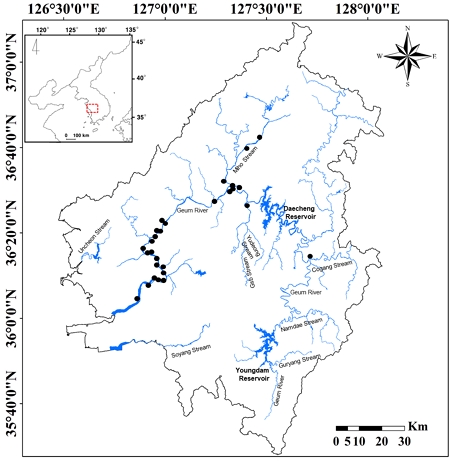
금강은 전라북도 장수군에서 발원하여 군산시에 위치한 하구언으로 유입되는, 총길이 394.79 km를 가진 큰 강이다. 금강의 상류지역과 중·하류지역에 각각 용담댐과 대청호가 건설되어 물 흐름이 인위적으로 조절되지만, 하상 구배가 적절하고 곡류 구간이 위치하여 비교적 양호한 하천 환경을 가진다. 이와 같은 환경특성으로 인해 금강 유역에서는 멸종위기에 처한 다양한 생물상이 서식하고 있는 등 생물다양성이 비교적 높다(Choi et al., 2020b; Kim et al., 2022). 금강은 ‘4대강 하천정비사업’으로 인해 2009년부터 2012년까지 하도 및 둔치의 대대적인 개선 사업이 이루어졌으며, 이 과정에서 다양한 하도 및 배후습지가 훼손되거나 사라졌다. 본 연구의 대상지인 32개의 신규조성습지(Fig. 1)는 기존에 습지를 대체하기 위한 목적으로 조성된 것이다. 이 습지들은 조성 당시 유입·유출구를 건설하고, 하도구배를 적절하게 조성하였으나, 오랜 시간 동안 관리되지 않아 유입·유출구의 기능이 악화되고 저토가 축적되면서 습지로서의 본래 기능을 상실하였다.
2.2. 환경 요인 측정 및 동물플랑크톤 채집
환경 요인의 측정 및 동물플랑크톤 채집은 금강 유역에 위치한 32개 신규조성습지에서 5~6월 동안 월 2회 수행되었다. 한국에서 여름철에 집중된 강우는 동물플랑크톤의 종조성과 군집 구조에 강하게 영향을 미치며, 이에 대한 영향이 가을까지 연쇄적으로 발생하기 때문에(Choi et al., 2011; Choi and Kim, 2020a), 강우 외 다른 요인에 대한 영향을 평가하기 위해서는 봄철이 가장 적당하다. 환경요인은 각 습지에서 수심, 수온, pH, 용존산소(dissolved oxygen, DO), 전기전도도, 탁도, 총질소(total nitrate), 총인(total phosphorus), 엽록소-a 등 8개 항목을 조사하였다. 수온과 용존산소, pH, 전기전도도는 현장에서 즉시 측정하였으며, 탁도, 엽록소a, 총질소, 총인 항목은 각 습지에서 채수 후 실험실에서 분석하였다. 수심 측정은 2 m 자를 이용하여 측정되었다. 수온과 용존산소는 DO meter(YSI, Model 58)를 이용하여 측정하였으며, pH와 전기전도도는 각각 pH 측정기(Orion, Model 58)와 전기전도도 측정기(Fisher Conductivity Meter, Model 152)를 이용하여 측정되었다. 탁도는 탁도측정기(Model 100B)를 이용하여 측정되었으며, 엽록소a, 총질소, 총인은 Wetzel and Likens(2000)의 흡광도법에 준하여 분석되었다.
동물플랑크톤 채집을 위한 원수 채수 전에 수생식물에 대해 먼저 조사하였다. 식물 피도에 대한 조사를 위해 각 습지에 방형구(1 x 1 m)를 무작위로 설치하였으며, 방형구 내 공간을 다시 25개 공간(0.2 x 0.2 m)으로 세분하여 각 공간에 대한 식물 피복 유무를 기반으로 각 습지당 식물 피도를 산출하였다. 수생식물의 피도를 산출한 후, 방형구 내에서 8-10 L의 시료가 채수되었다. 채수된 시료는 플랑크톤 네트(망목 68 um)에 여과하여 100 ml로 농축한 후 동물플랑크톤의 고정을 위해 5%의 포르말린 용액이 첨가되었다. 고정된 동물플랑크톤 시료는 현미경을 이용하여 속 수준까지 구분한 후 리터(L) 당 개체수로 환산하였다(Mizuno and Takahashi, 1999). 산출된 동물플랑크톤은 종조성과 밀도로 구분하여 분석되었으며, 이는 수생식물 및 환경요인과 상호관계 분석을 위해 활용되었다.
2.3. 자료 분석
신규조성습지의 환경 특성이 동물플랑크톤 종조성과 밀도에 미치는 영향을 파악하기 위해 비모수다차원척도법(non-metric multidimensional scaling, NMDS)을 활용하였다. NMDS 분석은 각 지점 간 측정 항목 간에 유사도 값을 이용하여 최적의 관계를 나타낼 수 있는 two dimensional ordination을 이용하였다(Field et al., 1982). 또한, 군집분석(cluster analysis)은 동물플랑크톤 군집을의 종조성과 개체수를 기반으로 습지들 간에 유사성을 분석하기 위해 추가적으로 분석되었다. 각 습지의 환경특성을 기반으로 근거로 한 군집 분석은 Jaccard(1908)의 방법을 활용하였으며, 산출된 유사도를 기준으로 각 지점별 유사거리를 비가중치 평균연결법(unweighted pair group method using arithmetic average, UPGMA)으로 군집화하였다. NMDS와 유사도 분석에서는 R 통계에서 제공하고 있는 vegan package를 사용하였다(Oksanen et al., 2014). 군집분석에 의해 구분된 2개의 집단간에 차이를 규명하기 위해 일원배치 분산분석(one-way analysis of variance, ANOVA)을 수행하기 위해 SPSS 통계프로그램(v.24)를 활용하였다.
3. 결과 및 고찰
3.1. 환경요인 및 식물상
금강유역에 위치한 32개 신규조성습지에서 조사된 환경요인과 식물상은 각 습지간에 상이했다(Table 1). 이 습지들의 평균 수심은 0.94 m였으며, 가장 깊은 수심과 얕은 수심은 각각 1.7 m와 0.2 m였다. 대부분의 습지들은 2 m 이하의 수심을 가짐으로써 빛의 유입이 원활하였고, 수생식물이 성장하기에 적당했다. 수온, pH, 전기전도도 항목은 변동계수(CV, coefficient of variation)가 0.5 미만으로 습지간 차이가 거의 없는 반면, 용존산소, 탁도, 총질소, 총인, 엽록소-a 등의 항목은 상대적으로 습지간에 큰 변동성을 나타냈다. 수중 DO는 대기 중의 산소가 수중으로 유입되는 정도에 의존하는데, 습지의 수표면은 봄철부터 가을철까지 수생식물에 의해 피복되므로 대기 중의 산소가 물 안으로 유입되기 어려워 DO 값이 낮을 수 있다(Reeder, 2011). 그 밖에 탁도, 총질소, 총인, 엽록소-a 값은 습지 주변으로부터 유입되는 물질에 의존적이므로, 각 습지의 주변 토지피복 상태에 따라 습지 간에 상이한 값이 나타날 수 있다. 습지 주변에 농경지나 주거지가 밀집된 경우, 총질소와 총인이 습지로 과도하게 유입될 가능성이 높고, 이는 탁도와 엽록소-a 값을 높이는 원인이 될 수 있다(Andrews et al., 2008). 또한, 영양염류의 지속적인 유입은 수생식물의 성장과 발달을 촉진시키므로, 수생식물의 수표면 피도 값을 증가시키게 된다(Uchida, 2000).

Ten environmental variables in 32 newly created wetlands located in the Geum RiverDep., water depth; WT, water temperature; DO, dissolved oxygen; Cond., conductivity; Tur. turbidity; TN, total nitrogen; TP, total phosphorus; Chl.a, chlorophyll a; MC, macrophytes cover; SD, standard deviation; CV, coefficient of variation
환경요인을 기반으로 분석된 군집분석 결과, 32개 신규조성습지는 크게 두 가지의 집단으로 구분되었다(Fig. 2). 첫 번째 집단(Cluster 1)은 15개 습지(1, 2, 4, 7, 8, 10, 13, 14, 19, 20, 21, 22, 25, 28, 29)로 구분되었으며, 두 번째 집단(Cluster 2)은 17개 습지 (3, 5, 6, 9, 11, 12, 15, 16, 17, 18, 23, 24, 26, 27, 30, 31, 32)가 포함되었다. 이 두 개의 집단에 속한 습지들은 8개 환경요인(수심, 용존산소, 탁도, 총질소, 총인, 총질소, 엽록소-a, 식물 피도)들의 분명한 차이가 확인되었다(Fig. 3 and Table 2). 첫 번째 집단은 수심, 용존산소, 탁도, 총질소, 총인, 엽록소-a가 낮고, 식물 피도가 높은 습지가 포함되었다. 두 번째 집단은 수심, 용존산소, 탁도, 총질소, 총인, 엽록소a가 높고, 식물 피도가 낮은 습지들이다. 이와 같은 군집 분석의 결과는 금강 유역에 위치한 신규조성습지들의 환경 특성이 크게 2가지로 구분된다는 것을 의미하며, 이는 각 습지의 통수 확보에 따른 기능적 차이로 사료된다.
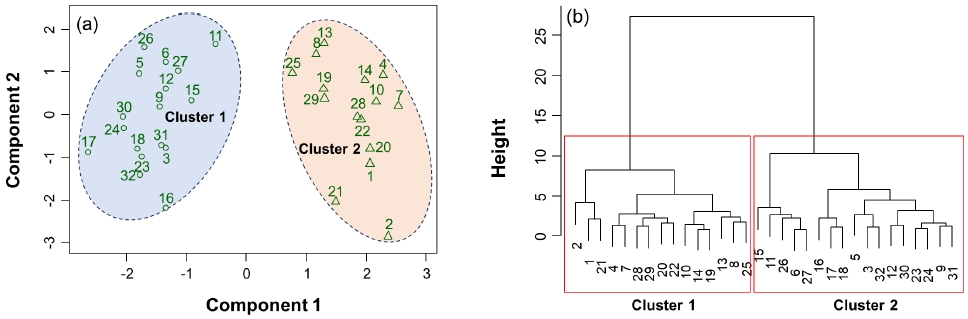
Clusplot (a) and dendrogram (b) for the hierarchical cluster analysis based on environmental variables investigated at 32 newly created wetlands located in the Geum River.
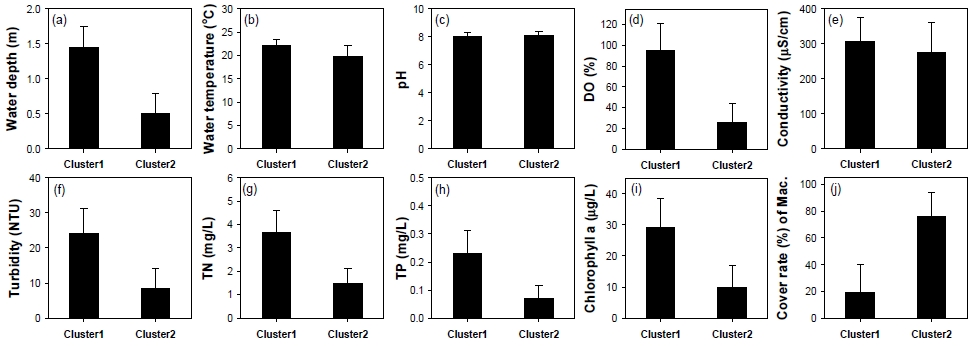
The mean and SD (standard deviation) of environmental variables between two clusters separated by the hierarchical cluster analysis. DO, dissolved oxygen; TN, total nitrogen; TP, total phosphorus; Mac., macrophytes.
금강 유역 뿐만 아니라 다른 강 유역에 위치한 신규조성습지 대부분은 조성 당시, 습지 내부의 원할한 통수 기능의 확보를 위해 습지의 상단 및 하단부에 각각 유입구와 유출구를 조성하였으나, 시간이 지남에 따라 수로에 토사가 퇴적되고 식물 고사체가 점령하면서 유입·유출구가 막혀 본래의 기능이 변형되었다(Choi et al., 2018; Son and Choi, 2021). 통수기능이 낮아진 이 습지들은 내부기원 유기물이 축적이나 유거수의 지속적인 유입에 의해 영양염(질소와 인 등) 농도가 높아지면서 부영양화 및 오염이 가속화되었으며, 엽록소-a와 식물 피도가 증가되었다. 이 습지들은 유입·유출구의 기능을 개선하거나, 또는 이와 다른 방법을 통해 본류수와의 지속적인 소통을 유지시키는 관리 전략이 필요하다.
그러나, 토사와 식물 고사체가 유입·유출부뿐만 아니라 습지 내부에도 축적되면서 습지보다 강 본류 수면의 고도가 낮게 되거나 하상구배가 완만해지면서 유입·유출구를 개선하여도 통수기능의 확보가 원활하지 않을 가능성 또한 존재한다(Choi et al., 2018). 따라서, 유입·유출구를 포함한 습지내부의 전체적인 기능 개선을 통해 습지의 과도한 부영양화와 오염 축적을 감소할 필요가 있다. 이와 대조적으로, 엽록소-a 농도와 식물 피도가 낮은 신규조성습지들은 조성 당시 건설된 유입·유출구의 기능이 유지되거나, 다른 경로를 통해 통수가 원활하게 확보된 습지들이다.
3.2. 환경요인 및 동물플랑크톤간의 관계
금강 유역에 위치한 32개 신규조성습지에서 조사된 동물플랑크톤은 총 40속, 26,828개체(ind./L)로 확인되었다. 주요 분류군별로는 Chydorus와 Pleuxus가 21곳의 습지에 출현함으로써 가장 우점하였고(Fig. 4), 그 다음으로는 Simocephalus와 Diaphanosoma가 각각 20곳과 19곳의 습지에서 출현하였다. 이들 4종의 동물플랑크톤은 수생식물의 잎과 줄기 표면에 주로 서식하는 부착 성향(epiphytic)을 가진 분류군으로, 선행연구에서도 수생식물의 피도가 높은 습지를 기반으로 관찰된다고 제시하였다(Celewicz-Gołdyn and Kuczyńska-Kippen, 2017; Liang et al., 2024). 또한, 부착성 동물플랑크톤은 식물의 잎과 줄기에 부착된 미세조류를 먹이로써 소비하기 때문에 수생식물이 풍부한 지역에 주로 분포한다(de Faria et al., 2017). 이와 대조적으로, 출현빈도가 낮은 Daphnia는 식물플랑크톤이나 박테리아를 여과 섭식하기 위해 지속적인 움직임을 가지며, 이 행동으로 인해 어류와 같은 포식자에게 쉽게 탐색되기 때문에 높은 밀도로서 분포하기 어렵다(Preciado et al., 2008; Choi et al., 2015). 윤충류인 Anuraeopsis, Ploesoma, Synchaeta가 습지에서 거의 관찰되지 않는 것 또한 Daphnia의 경우와 비슷한 이유이다. 비록, 기존 연구들은 부착성 뿐만 아니라 부유성 플랑크톤도 수생식물이 높게 피복된 지역에서 포식자의 탐색 효율성이 낮아져 소비될 가능성이 낮다고 제안하였지만(Manatunge et al., 2000; Horppila et al., 2009), 한국의 습지에서 우점하는 블루길은 수생식물에 의해 복잡하게 조성된 공간에서도 부유성 플랑크톤을 효율적으로 소비할 수 있다(Shoup et al., 2012).
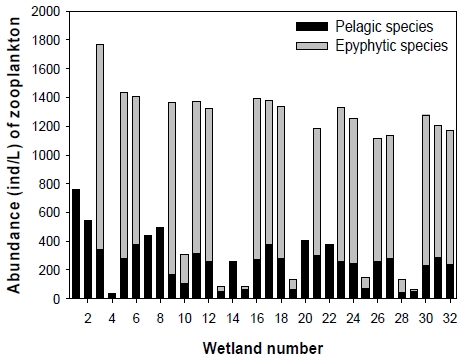
Abundance (ind/L) of zooplankton in 32 created wetland located Geum River. The zooplankton species were divided as pelagic species and epiphytic species.
총 32곳의 습지 중 가장 높은 동물플랑크톤 밀도가 목격된 습지는 3번 습지로 총 1,767.5 ind/L였다. 3번 습지 외에도 17개 습지들(5, 6, 9, 11, 12, 16, 17, 18, 21, 23, 24, 26, 27, 30, 31, 32번)에서 1,000 ind/L 이상의 동물플랑크톤 밀도가 관찰되었다. 이 17개 습지에서는 부유성 동물플랑크톤보다 부착성 동물플랑크톤이 차지하는 비율이 매우 높았다. 특히, 17개 습지 중 12개 습지(3, 5, 6, 9, 11, 12, 16, 17, 18, 23, 24, 30번)에서 부착성 동물플랑크톤의 밀도는 1,000 ind/L 이상이었다. 부유성 동물플랑크톤이 우점하는 습지는 모두 800 ind/L 이하의 밀도가 관찰되었으며, 이는 부착성 동물플랑크톤이 우점하는 습지와 비교할 때 절반 이하의 밀도 수준이었다. 부착성 동물플랑크톤의 밀도가 높은 습지들은 대부분 수생식물의 피도가 높은 지역었으며, 이 지역에서 풍부한 식물의 잎과 줄기는 부착성 동물플랑크톤들의 안정적인 개체군 성장을 유도한 것으로 판단된다.
군집분석 결과에서, 첫 번째 집단보다 두 번째 집단에 속한 습지들에서 동물플랑크톤 속들의 출현빈도가 높았다. 두 번째 집단에서, 16곳 이상의 습지에서는 19속의 동물플랑크톤이 관찰되었고, 13개 이상의 습지에서는 4속이 출현하였다(Table 3). 32개의 신규조성습지에서 출현한 동물플랑크톤이 총 40속인 점을 감안하면, 13곳 이상의 습지에서 전체의 57.5%(23속)가 관찰된 것이다. 이 23속의 대부분은 부착 성향을 가진 동물플랑크톤이었다. 그러나, 두 번째 집단에 속한 습지에서는 Anuraeopsis. Keratella, Euchlanis, Mytilina, Pomplholyx, Filinia, Ploesoma, Polyarthra, Synchaeta, Bosmina, Camptocercus, Daphnia, Mesocyclops 등의 동물플랑크톤 속은 출현하지 않았다. 이 동물플랑크톤들은 대부분 부유성의 서식 형태를 가지기 때문에 수생식물의 피도가 높은 두 번째 집단에서 출현빈도가 적은 것으로 파악된다. 대조적으로, 첫 번째 집단에 속한 습지들에서 부착성 동물플랑크톤(Lecane, Monostlyla, Testudinella, Graptoleveris)의 출현빈도는 상대적으로 낮았다. 두 집단 간에 상이한 동물플랑크톤의 군집 구조 차이는 두 집단에 속한 습지의 환경 특성이 상이하다는 것을 의미하는데, 특히, 수생식물의 피도는 동물플랑크톤의 종조성 차이를 야기하는 중요한 환경 특성으로 인식된다(Celewicz-Gołdyn and Kuczyńska-Kippen, 2017). 선행 연구에서도 부착성 동물플랑크톤(Lecane, Monostlyla, Testudinella, Graptoleveris)들은 수생식물과 밀접한 상관관계를 가지는 것으로 제안하였다(Messyasz et al., 2009; Choi et al., 2020a). 예를 들어, 핀란드 동부에 위치한 사이마아 호수에서 분포하는 부착성 동물플랑크톤들은 수생식물의 생물량이 증가할수록 밀도와 종다양성이 증가하였다(Tolonen et al., 2005). 수생식물의 생물량이 증가되었다는 것은 이들의 잎과 줄기가 풍부하여 부착성 동물플랑크톤이 부착 가능한 기질 표면이 증가되었다는 것이므로, 부착성 동물플랑크톤의 먹이와 서식처가 충분하다는 것을 의미한다.

Genera list of zooplankton community in created wetlands divided by cluster analysis The genera with * mark were considered as epiphytic cladoceran species, in accordance with Sakuma et al. (2000) and Gyllstrom et al. (2005). +, observation in less than four wetlands; ++, observation at five to eight wetlands; +++, observation at nine to twelve wetlands; ++++, observation at thirteen to sixteen wetlands
32개 신규조성습지들의 환경요인과 동물플랑크톤 군집의 속별 개체수를 이용하여 NMDS 분석을 시행한 결과, 수생식물 및 환경요인을 기반한 한 집단분석과 유사하게 구분되었다(stress value, 0.35; Fig. 5). 2번 축을 기준으로 상단 부분에는 첫 번째 집단(cluster 1)에 속한 습지들이 위치하였으며, 하단부에는 두 번째 집단(cluster 2)에 속한 습지들이 위치했다. 첫 번째 집단에 속한 동물플랑크톤들은 DO, 수심, 총질소, 그리고 엽록소-a가 높은 값을 가진 습지에서 주로 출현하였고, 집단 2에 속한 동물플랑크톤 종들은 수생식물의 피도와 밀접하게 연관되었다. 두 번째 집단에 속한 동물플랑크톤은 대부분 부착성으로 수생식물의 피도와 밀접하게 관련되었다.
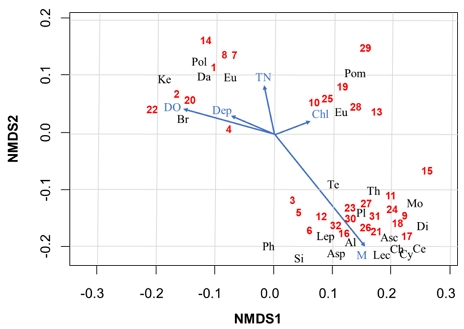
The None-metric multidimensional scaling(NMDS) of 40 zooplankton taxa (letters) and 32 sampling time. The blue arrows represent the associations with macrophytes cover rate (%) and environmental variables. M., macrophytes cover; DO, dissolved oxygen; Dep., depth; TN, total nitrogen; Chl., chlorophyll a.
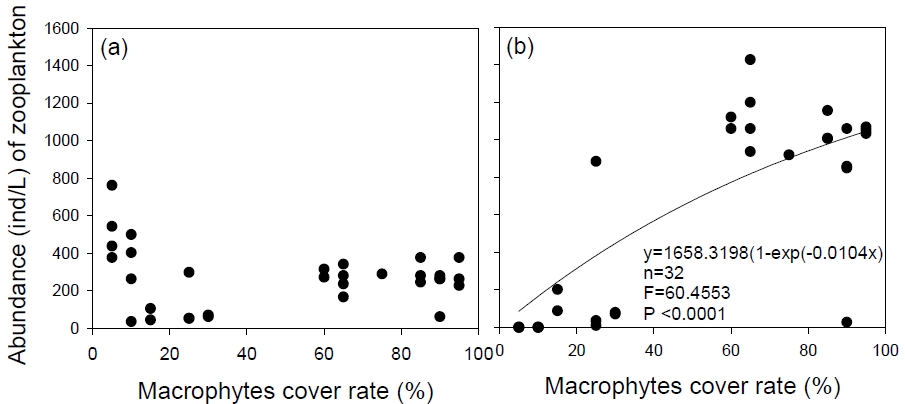
각 습지에서 수생식물의 피도는 부착성 동물플랑크톤의 밀도를 증가시키는 중요한 요인인 것으로 나타났다. 32개 습지에서 수생식물의 피도는 부유성 동물플랑크톤의 밀도와 관련성이 낮았지만, 부착성 동물플랑크톤의 밀도와 밀접하게 관련되었다(F = 60.46, p < 0.0001; Fig. 6). 이것은 각 습지에서 부착성 동물플랑크톤의 밀도가 수생식물의 피도에 의해 강하게 영향받는다는 것을 의미한다. 전술하였듯이, 부착성 동물플랑크톤은 식물의 잎이나 줄기 표면에 서식할 뿐만 아니라 잎과 줄기에 미세조류를 먹이로써 소비하기 때문에 수생식물 피도의 증가는 부착성 동물플랑크톤의 증가를 야기할 수 있다(de Faria et al., 2017).
3.3. 동물플랑크톤 종다양성 확보를 위한 신규조성습지의 관리전략
금강 유역에 조성된 32개 신규조성습지는 다양한 환경 특성에 의해 지배되는 것으로 파악되었다. 이 습지들에서 가장 두드러지는 특성은 환경 특성은 ‘식물의 피복 상태’이며, 이는 습지의 물리적 및 환경적 요인에 의해 강하게 영향을 받는 것으로 나타났다. 일반적으로, 수생식물은 주로 수심이 2 m 이하에서 성장하기 때문에 수심이 깊거나 탁도가 높은 습지들에서는 수중으로 빛의 유입이 원활하지 않아 식물이 발아하거나 성장하기 어렵다. 또한, 지속적인 흐름이 발생되거나 건천화되기 쉬운 습지들은 수생식물의 발달이 어려울 수 있다.
금강 외에 다른 강 유역에 조성된 신규조성습지들의 선행 연구에서는 습지의 하도구배, 유입·유출구의 기능, 호안부의 침식 여부가 습지의 환경 특성에 영향을 미친다고 제안하였다(Palmeri et al., 2000; Choi et al., 2018; Czuba et al., 2018; Kim et al., 2022b). 이와 같은 습지들은 조성 당시 적절한 하도구배와 통수 기능이 원할한 유입 및 유출구가 조성되었지만, 시간이 지나면서 토사나 식물 고사체나 축적되면서 점차적으로 기존 습지로서의 기능이 훼손되거나 저하된 것으로 판단된다. 금강에 위치한 신규조성습지 또한 고층습원의 형태로 발달하거나 유입 및 유출구의 기능이 감소된 경우가 많았으며, 조성 당시의 본래 기능이 유지되고 있는 습지는 소수에 불과했다. 대부분은 통수기능이 원활하지 못해 영양염류나 오염물질이 내부순환에 의해 고동도로 축적되어 부영양화 상태가 유지되었다.
비록, 본 연구에서는 식물의 종별 형태나 구조에 대한 동물플랑크톤의 군집 구조의 영향에 대해 고려하지 않았지만, 금강 유역에 조성된 신규조성습지에서 출현한 동물플랑크톤 군집은 식물 군락 형태나 구조에 강하게 영향받을 것으로 사료된다. 다양한 선행연구 또한 동물플랑크톤의 종조성과 군집 구조는 수생식물의 잎이나 줄기 구조에 영향받는다고 언급했다(Manatunge et al., 2000; Celewicz-Gołdyn and Kuczyńska-Kippen, 2017). 이를 기반으로, 각 신규조성습지의 수생식물의 종조성과 군락 형태가 동물플랑크톤의 종조성과 군집 구조를 결정하는데 중요하게 작용했을 것으로 판단된다.
식생 군락 내 식물 풍부도와 종다양성은 서식처의 복잡성과 효율성을 증가시키므로, 단일 식물로 구성된 식생군락이 우점하거나 식물 발달이 저조한 습지는 개선할 필요가 있다. 금강 유역에 위치한 신규조성습지들은 적절한 하상구배의 유지 및 통수 기능 확보 등의 환경 특성을 개선함으로써 다양한 식물이 성장과 발달을 유도하여 생물의 서식처로의 가치를 확보할 필요가 있다. 습지의 호안부는 식물 뿌리가 활착하기에 용이한 형태로 개선하거나, 통수를 확보하기 위해 유입 및 유출구의 기능을 향상시키는 방안은 다양한 식물의 성장을 촉진하는 신규조성습지의 주요한 변경사항이다. 이러한 습지의 개선과 관리 노력들은 신규조성습지의 서식처 효율성을 증가시키고 동물플랑크톤 군집을 포함한 생물다양성을 증가시키는 결정적인 요인이 될 것으로 기대된다.
4. 결 론
금강유역에 조성된 32개 신규조성습지는 환경요인을 기반으로 두 개의 집단으로 구분되었다. 첫 번째 집단(cluster 1)은 깊은 수심과 높은 용존산소, 총질소, 엽록소-a 농도를 가진 습지들이 포함되었으며, 두 번째 집단(cluster 2)는 수생식물의 높은 피도가 특징인 습지들이었다. 동물플랑크톤의 종조성과 군집 구조 또한 이 군집분석의 결과와 유사했다. 두 번째 집단에 속한 습지들에서 동물플랑크톤은 Lecane, Monostlyla, Testudinella, Graptoleveris와 같은 부착 성향의 속들이 주로 목격된 반면, 첫 번째 집단에서는 주로 Daphnia와 Simocephalus 등의 부유성 속들의 출현빈도가 높았다. 두 번째 집단에서는 수생식물의 피도가 높은 습지들이 포함되었고, 이에 따라 식물의 잎이나 줄기에 서식하는 동물플랑크톤의 출현율이 높은 것으로 파악된다. 부유성 동물플랑크톤 또한 수생식물을 서식처로써 활용하지만, 부착성 동물플랑크톤보다 식물을 활용하는 빈도가 낮고, 지속적인 움직임 때문에 포식자의 먹이 탐색 시 먼저 소비되므로 습지에서 부착성 종에 비해 낮은 밀도를 가진다. 동물플랑크톤 군집의 종성과 군집 구조는 습지의 식생 피복에 의해 강하게 영향받으므로, 습지의 식물 식재에 대한 계획과 지속적인 관리가 동물플랑크톤의 종다양성 확보와 유지에 기여할 것으로 판단된다.
Acknowledgments
이 논문은 2023년도 부경대학교 자율창의학술연구비 지원에 의하여 수행되었습니다.
REFERENCES
- Andrews, C., Kroger, R., Miranda. L., 2008, Predicting nitrogen and phosphorus concentrations using chlorophyll-a fluorescence and turbidity, Proceedings of the Mississippi Water Resources Conference, Mississippi, 155-159.
-
Blechinger, T., Link, D., Nelson, J. K., & Hansen, G. J., 2024, Estimating ethanol correction factors for δ13C and δ15N isotopic signatures of freshwater zooplankton from multiple lakes, Limnol. Oceanogr. Methods, 22, 464-472.
[https://doi.org/10.1002/lom3.10623]

-
Bunn, S. E., Boon, P. I., 1993, What sources of organic carbon drive food webs in billabongs? A Study based on stable isotope analysis, Oecologia, 96(1), 85-94.
[https://doi.org/10.1007/BF00318034]

-
Celewicz-Gołdyn, S., Kuczyńska-Kippen, N., 2017, Ecological value of macrophyte cover in creating habitat for microalgae (diatoms) and zooplankton (rotifers and crustaceans) in small field and forest water bodies, PLoS One, 12(5), e0177317.
[https://doi.org/10.1371/journal.pone.0177317]

-
Chen, M., Chen, F., 2017, Effect of suspended solids on interaction between filter-feeding fish Aristichthys nobilis and zooplankton in a shallow lake using a mesocosm experiment, J. Freshw. Ecol., 32(1), 219-227.
[https://doi.org/10.1080/02705060.2016.1262293]

-
Choi, J. Y., Jeong, K. S., Kim, H. W., Chang, K. H., Joo, G. J., 2011, Inter-annual variability of a zooplankton community: The importance of summer concentrated rainfall in a regulated river ecosystem, J. Ecol. Environ., 34(1), 49-58.
[https://doi.org/10.5141/JEFB.2011.007]

-
Choi, J. Y., Kim, S. K., Chang, K. H., Kim, M. C., La, G. H., Joo, G. J.. Jeong, K. S., 2014, Population growth of the cladoceran, Daphnia magna: A Quantitative analysis of the effects of different algal food, PloS one, 9(4), e95591.
[https://doi.org/10.1371/journal.pone.0095591]

-
Choi, J. Y., Kim, S. K., Jeong, K. S., Joo, G. J., 2015, Distribution pattern of epiphytic microcrustaceans in relation to different macrophyte microhabitats in a shallow wetland (Upo wetlands, South Korea), Oceanol. Hydrobiol. Stud., 44(2), 151-163.
[https://doi.org/10.1515/ohs-2015-0015]

-
Choi, J. Y., Kim, S. K., Park, J. S., Kim, J. C., Yoon, J. H., 2018, Fish distribution and management strategy for improve biodiversity in created wetlands located at Nakdong River basin, Korean J. Environ. Ecol., 32(3), 274-288.
[https://doi.org/10.13047/KJEE.2018.32.3.274]

-
Choi, J. Y., Kim, S. K., 2020a, Responses of rotifer community to microhabitat changes caused by summer-concentrated rainfall in a shallow reservoir, South Korea, Diversity, 12(3), 113.
[https://doi.org/10.3390/d12030113]

-
Choi, J. Y., Kim, S. K., Kim, J. C., Yun, J. H., 2020b, Effect of microhabitat structure on the distribution of an endangered fish, Coreoperca kawamebari (Temminck & Schlegel, 1843) in the Geum River, South Korea, Water, 12(6), 1690.
[https://doi.org/10.3390/w12061690]

-
Czuba, J. A., Hansen, A. T., Foufoula-Georgiou, E., Finlay, J. C., 2018, Contextualizing wetlands within a river network to assess nitrate removal and inform watershed management, Water Resources Research, 54(2), 1312-1337.
[https://doi.org/10.1002/2017WR021859]

-
de Faria, D. M., Cardoso, L. D. S., da Motta Marques, D., 2017, Epiphyton dynamics during an induced succession in a large shallow lake: wind disturbance and zooplankton grazing act as main structuring forces, Hydrobiologia, 788, 267-280.
[https://doi.org/10.1007/s10750-016-3002-5]

-
Dallas, T., Drake, J. M., 2014, Relative importance of environmental, geographic, and spatial variables on zooplankton metacommunities, Ecosphere, 5(9), 1-13.
[https://doi.org/10.1890/ES14-00071.1]

-
Field, J. G., Clarke, K. R., Warwick, R. M., 1982, A Practical strategy for analysing multispecies distribution patterns, Mar. Ecol. Prog. Ser., 8, 37-52.
[https://doi.org/10.3354/meps008037]

-
Flinn, M. B., Whiles, M. R., Adams, S. R., Garvey, J. E., 2005, Macroinvertebrate and zooplankton responses to emergent plant production in upper Mississippi River floodplain wetlands, Archiv fur Hydrobiologie, 162(2), 187-210.
[https://doi.org/10.1127/0003-9136/2005/0162-0187]

-
Gutierrez, M. F., Epele, L. B., Mayora, G., Aquino, D., Mora, C., Quintana, R., Mesa, L., 2022, Hydro-climatic changes promote shifts in zooplankton composition and diversity in wetlands of the Lower Parana River Delta, Hydrobiologia, 849(16), 3463-3480.
[https://doi.org/10.1007/s10750-022-04955-0]

-
Horppila, J., Eloranta, P., Liljendahl-Nurminen, A., Niemist, J., Pekcan-Hekim, Z., 2009, Refuge availability and sequence of predators determine the seasonal succession of crustacean zooplankton in a clay-turbid lake, Aquat. Ecol., 43, 91-103.
[https://doi.org/10.1007/s10452-007-9158-3]

-
Im, R. Y., Kim, J. Y., Nishihiro, J., Joo, G. J., 2020, Large weir construction causes the loss of seasonal habitat in riverine wetlands: A Case study of the Four Large River Projects in South Korea, Ecological engineering, 152, 105839.
[https://doi.org/10.1016/j.ecoleng.2020.105839]

- Jaccard, P., 1908, Nouvelles recherches sur la distribution florale, Bulletin Society Sciences Naturale, 44, 223-270.
-
Ji, C. W., Oh, H. J., Chang, K. H., Park, Y. S., Kwak, I. S., 2022, A Comparative analyzing of zooplankton community diversity in surface layer water of reservoir via eDNA metabarcoding and microscopy, Diversity, 14(10), 797.
[https://doi.org/10.3390/d14100797]

-
Kattel, G. R., Eyre, B. D., Gell, P. A., 2020, Integration of palaeo-and-modern food webs reveal slow changes in a river floodplain wetland ecosystem, Scientific Reports, 10(1), 12955.
[https://doi.org/10.1038/s41598-020-69829-8]

-
Kim, K. S., Kang, D. W., Kim, K. Y., Heo, J. S., Song, H. Y., Yoon, J. D., 2022, Characterization of the complete mitogenome of the endangered freshwater fish Gobiobotia naktongensis from the Geum River in South Korea: Evidence of stream connection with the Paleo-Huanghe, Genes & genomics, 44(8), 945-956.
[https://doi.org/10.1007/s13258-022-01265-6]

-
Kim, S. K., Joo, G. J., Choi, J. Y., 2022a, Effect of gated weir opening on the topography and zooplankton community of Geum River, South Korea, Land, 11(4), 529.
[https://doi.org/10.3390/land11040529]

-
Kim, S. K., Yun, J. H., Joo, G. J., Choi, J. Y., 2022b, Hydrological characteristics and trophic status as dominant drivers of rotifer community composition in artificially created riverine wetlands, Animals, 12(4), 461.
[https://doi.org/10.3390/ani12040461]

-
Lee, H., Koo, M. H., Cho, B. W., Oh, Y. H., Kim, Y., Cho, S. Y., Lee, J. Y., Kim, Y., Kim, D. H., 2020, Effects of baekje weir operation on the stream-aquifer interaction in the Geum River basin, South Korea, Water, 12(11), 2984.
[https://doi.org/10.3390/w12112984]

-
Liang, D., Huang, C., Lin, S., Dong, J., Liang, M., Luo, H., 2024, Epiphytic zooplankton community profiles in a typical urban wetland as revealed by DNA metabarcoding, J. Oceanol. Limnol., 1-15.
[https://doi.org/10.1007/s00343-024-3148-3]

-
Lomartire, S., Marques, J. C., Goncalves, A. M., 2021, The key role of zooplankton in ecosystem services: A Perspective of interaction between zooplankton and fish recruitment, Ecol. Indic., 129, 107867.
[https://doi.org/10.1016/j.ecolind.2021.107867]

-
Manatunge, J., Asaeda, T., Priyadarshana, T., 2000, The influence of structural complexity on fish-zooplankton interactions: A Study using artificial submerged macrophytes, Environ. Biol. Fishes, 58, 425-438.
[https://doi.org/10.1023/A:1007691425268]

-
Messyasz, B., Kuczyńska-Kippen, N., Nagengast, B., 2009, The epiphytic communities of various ecological types of aquatic vegetation of five pastoral ponds, Biologia, 64, 88-96.
[https://doi.org/10.2478/s11756-009-0006-x]

- Mizuno, T., Takahashi, E., 1999, An Illustration Guide to Freshwater Zooplankton in Japan, Tokai University, Tokyo, Japan.
- Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B., Simpson, G. L., Solymos, P., Stevens, M. H. H., Wagner, H., 2015, Package ‘Vegan’, Community Ecology Package, Vers. 2.2-1, http://cran.r-project.org/web/packages/vegan/index.html, (accessed on 20 February 2024).
- Palmeri, L., Persson, J., Pieterse, N. M., Timmermann, T., Bendoricchio, G., Kluge, W., Jørgensen, S. E., 2000, Models for wetland planning, design and management, EcoSys Bd, 8, 93-137.
-
Portinho, J. L., Perbiche-Neves, G., Nogueira, M. G., 2016, Zooplankton community and tributary effects in free-flowing section downstream a large tropical reservoir, Int. Rev. Hydrobiol., 101(1-2), 48-56.
[https://doi.org/10.1002/iroh.201501798]

-
Preciado, I., Velasco, F., Olaso, I., 2008, The role of pelagic fish as forage for the demersal fish community in the southern Bay of Biscay, Journal of Marine Systems, 72(1-4), 407-417.
[https://doi.org/10.1016/j.jmarsys.2007.04.007]

-
Reeder, B. C., 2011, Assessing constructed wetland functional success using diel changes in dissolved oxygen, pH, and temperature in submerged, emergent, and open-water habitats in the Beaver Creek Wetlands Complex, Kentucky (USA), Ecol. Eng., 37(11), 1772-1778.
[https://doi.org/10.1016/j.ecoleng.2011.06.018]

-
Scofield, A. E., Watkins, J. M., Rudstam, L. G., 2020, Heterogeneity in zooplankton distributions and vertical migrations: Application of a laser optical plankton counter in offshore Lake Michigan, J. Great. Lakes Res., 46(4), 780-797.
[https://doi.org/10.1016/j.jglr.2020.01.005]

- Seuront, L., Yamazaki, H., Souissi, S., 2004, Hydrodynamic disturbance and zooplankton swimming behavior, Zoo. Stud., 43(2), 376-387.
-
Shoup, D. E., Nannini, M. A., Wahl, D. H., 2012, The effect of vegetation density on juvenile bluegill diet and growth, J. Freshw. Ecol., 27(2), 199-209.
[https://doi.org/10.1080/02705060.2011.641357]

-
Son, S. H., Choi, J. Y., 2021, Influence of environmental characteristics on the community structure of benthic macroinvertebrates in stream-type waterways constructed at upper reaches of Guem River, J. of Ecol. Environ., 54(1), 24-38.
[https://doi.org/10.11614/KSL.2021.54.1.024]

-
Tolonen, K. T., Holopainen, I. J., Hamalainen, H., Rahkola-Sorsa, M., Ylostalo, P., Mikkonen, K., Karjalainen, J., 2005, Littoral species diversity and biomass: Concordance among organismal groups and the effects of environmental variables, Biodiversity & Conservation, 14, 961-980.
[https://doi.org/10.1007/s10531-004-8414-2]

- Uchida, R., 2000, Essential nutrients for plant growth: Nutrient functions and deficiency symptoms, Plant nutrient management in Hawaii’s soils, 4, 31-55.
-
Vincent, K., Mwebaza-Ndawula, L., Makanga, B., Nachuha, S., 2012, Variations in zooplankton community structure and water quality conditions in three habitat types in northern Lake Victoria, Lakes Reserv., 17(2), 83-95.
[https://doi.org/10.1111/j.1440-1770.2012.00504.x]

-
Wojtal-Frankiewicz, A., Frankiewicz, P., 2011, The impact of pelagic (Daphnia longispina) and benthic (Dreissena polymorpha) filter feeders on chlorophyll and nutrient concentration, Limnologica, 41(3), 191-200.
[https://doi.org/10.1016/j.limno.2010.09.001]

-
Zhao, C., Liu, C., Zhao, J., Xia, J., Yu, Q., Eamus, D., 2013, Zooplankton in highly regulated rivers: Changing with water environment, Ecol. Eng., 58, 323-334.
[https://doi.org/10.1016/j.ecoleng.2013.07.035]

-
Zhao, Q., Liu, S., Niu, X., 2020, Effect of water temperature on the dynamic behavior of phytoplankton–zooplankton model, Appl. Math. Comput., 378, 125211.
[https://doi.org/10.1016/j.amc.2020.125211]

Department of Environmental Engineering, Pukyong University jyc311@pknu.ac.kr