엽록소 형광 분석을 활용한 착색기 감귤의 고온 스트레스 평가
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was conducted in the greenhouse of the Citrus Research Institute of the Rural Development Administration with the aim of analyzing electron transfer efficiency in citrus under high temperatures caused by climate change and selecting photophysiological indicators to identify high temperature resistant varieties. The “Shiranuhi” cultivar showed no change in maximum fluorescence or Origin-Jump transition stage due to the heat treatment. However, chlorophyll fluorescence parameters, such as RC/CS, ABS/CS, and ETo/CS, increased. Consequently, it was judged that there was no decrease in photosynthetic performance due to high temperature. However, compared to mandarin orange, “unshiu Marcow” was found to have damage to the photosynthetic apparatus due to a significant increase in chlorophyll fluorescence in the O-J transition stage. It was also evaluated as Group III, with the lowest level of high-temperature resistance even in the high-temperature stress index analysis using PI ABS, making it the most vulnerable to high temperatures among the five varieties tested. In conclusion, chlorophyll fluorescence reaction analysis can be used for heat cultivation technology by selecting resistant varieties and identifying the appropriate temperatures.
Keywords:
Chlorophyll fluorescence (OJIP), Citrus tree, Green house, Heat stress, Hot air blower1. 서 론
감귤은 상록과수로 추위에 약해 최저기온이 -7℃ 이상인 지역에 국한되어 재배되고 있다. 기후학적으로 한국의 남쪽 지역인 제주도는 감귤류 재배의 북방 한계지역에 위치해 있어, 감귤류 중에서도 내한성이 강한 온주밀감을 주로 재배하고 있다(Moon et al., 2015). 온주밀감은 연평균 기온이 15.6~16.9℃인 제주도에서 노지 재배가 가능하지만, 만감류는 재배에 필요한 연평균 기온이 낮아 대부분 하우스에서 재배하고 있다(Moon et al., 2017). 만감류인 부지화는 미기상에 민감하여 온도가 상승하면 봄에 새순 발생이 줄고 엽면적이 증가하여 광합성 효율이 증가하지만(Moon et al., 2015), 지속적인 고온 노출시 엽면적이 과도하게 증가하여 광의 투과가 억제되고 과실의 품질이 저하된다(Ge et al., 2012). 고온 피해를 받은 감귤은 생육이 감소되고 개화 시기와 기간이 변동되며, 안토시아닌과 카로티노이드 같은 색소가 파괴되어 대사 과정에 장애가 생겨 과실 낙과가 증가하고 수확량이 감소하게 된다(Abobatta, 2019). 감귤 재배 시 고온 피해를 최소화하기 위해 과실 착색과 부피과 발생 등 과실에 관련된 연구(Kitazono et al., 2012)와 분자생물학적 연구가 보고되었으나(Ahn et al., 2016), 고온 스트레스에 따른 잎의 생리학적 변화와 피해에 관한 광생리 분야 연구는 부족하다. 엽록소 형광 분석법 중 하나인 OJIP (Origin jump intermediate peak)는 2 ms 이내의 엽록소 형광 현상으로 빛 의존적 전이(PSII)과 열의존적인 전이(PSI)를 수치로 계량화하여 각각의 phase를 정량화 한 것이다(Papageorgiou and Govindjee 2004). OJIP 전이과정은 광합성계 II 광화학적 양자 수득률의 포텐셜과 전자전달 능력을 좌우하며, 각 전이 단계의 엽록소 형광반응에 근거하여 광화학 기구 간 전자전달효율 및 식물의 건전성 예측이 가능하다(Strasser et al., 2004). 또한 광합성계 II에서 일어나는 세 가지 주요 기능 단계(광에너지의 흡수, 여기된 에너지의 트래핑, 여기 에너지의 전자 전달 변환)를 결합한 성능 지수인 PI ABS로 계산한 SFI(Stress factor index)는 콩의 유전자형에 따른 저온 내성을 평가 및 보리 품종에 따른 건조 스트레스 내성을 평가하는데 유용하게 활용되었다(Strauss et al., 2006; Oukarroum et al., 2007). 본 연구는 가온 재배로 인한 고온 환경이 감귤의 광합성 기구의 전자전달 효율에 미치는 영향을 분석하여, 품종별 적정 온도를 구명하고 고온 내성 품종 선발에 활용할 수 있는 광화학 지표를 도출하여 시설 가온 재배에 적합한 품종을 선발하기 위한 기초자료를 제공하고자 수행하였다.
2. 재료 및 방법
2.1. 실험재료
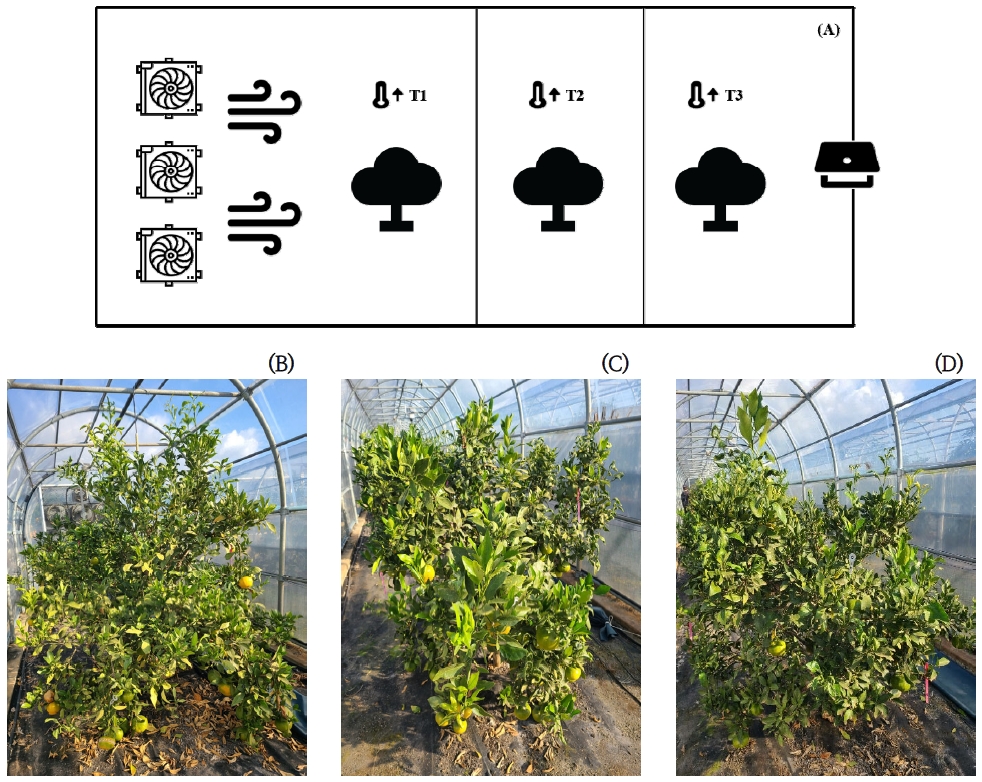
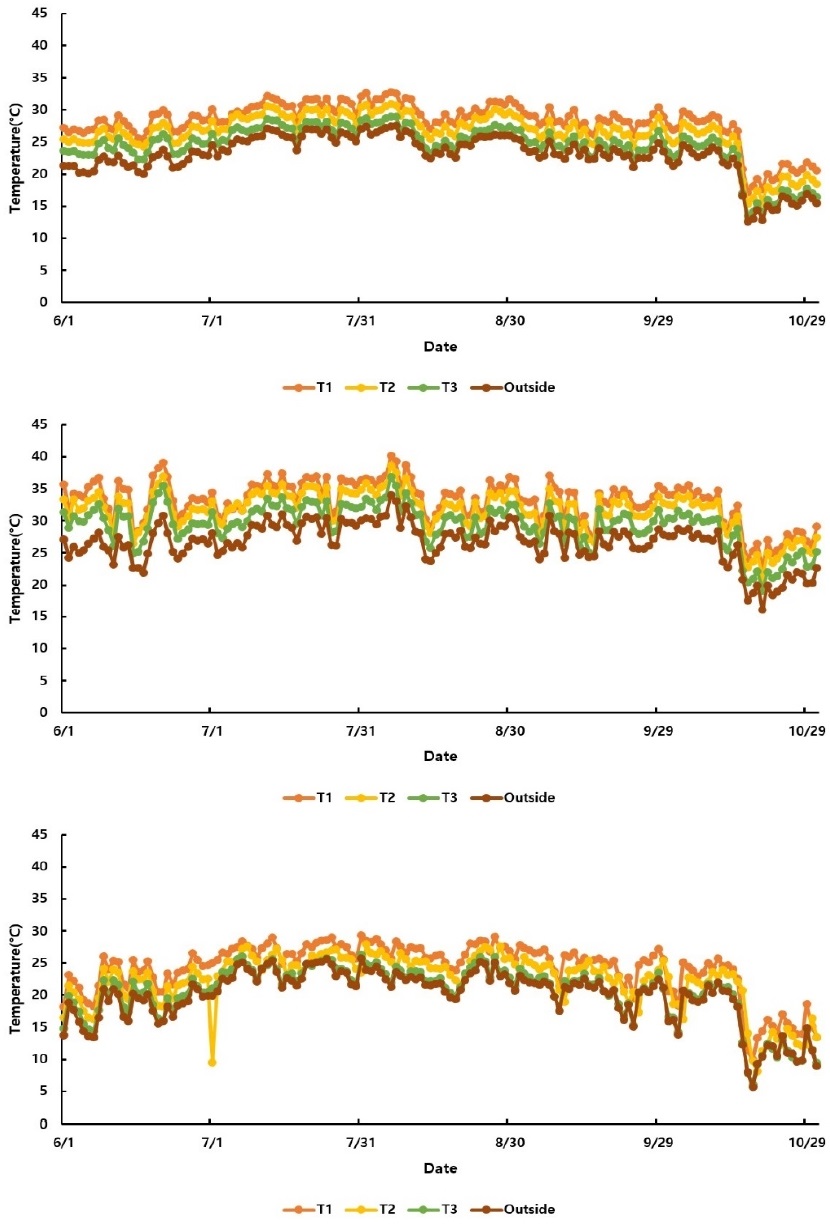
본 연구는 제주특별자치도 서귀포시 남원읍 하례리에 위치한 농촌진흥청 국립원예특작과학원 감귤연구소 시험 포장에서 기존 일본에서 육종된 감평(Citrus hybrid ‘Kanpei’), 남진해(C. hybrid ‘Natsumi’), 국내 만감류 재배면적이 가장 넓은 부지화(C. hybrid ‘Shiranuhi’), 우리나라에서 육종된 만감류 품종인 신예감(C. hybrid ‘Sinyegam’), 대한민국에서 육성한 첫 온주밀감인 하례조생(C. unshiu Marcow)을 대상으로 각 품종별 별도의 가온 하우스에서 재배(재식간격 2 m)를 실시하였다. 가온 하우스의 규격은 가로 2.6 m, 세로 30 m, 높이 2.8 m(열풍기 부분 제외시 가로 2.6 m, 세로 27 m)이며 근적외선방식의 열풍기(6.4 kW)를 사용하였다. 가온 하우스 내 온도는 출입구지점부터 0 m(외기), 1.5 m(T3), 13.5 m(T2), 25.5 m(T1)지점에 온도센서(1400-101, LI-COR Inc., USA)를 설치하여 데이터를 수집(CR1000, Campbell Scientific Inc., USA)하였다. 각 처리구별 온도를 10분 간격으로 측정하여 일평균 및 일최고기온을 모니터링하였다.
2.2. 처리내용
2021년 1월부터 가온하우스 내 각 처리구 온도를 외부온도 대비 2℃(T3)~6℃(T1) 높게 가온 처리를 실시하였으며, 공기 순환은 입구에 있는 환풍기를 통해서 24시간 순환하였다. 이때 가온 처리구는 열풍기로부터 9 m 간격으로 구분하여 T1(0~9 m), T2(9~18 m), 그리고 출입구 지점을 T3(18~27 m)로 하였다(Fig. 1A).
2.3. 엽록소 형광 분석
엽록소 형광 측정은 감귤 가지 상단을 기준으로 3~5번째의 완전히 전개된 잎을 대상으로 leaf clip으로 30분 암 처리 후 엽록소 형광 분석기 (FP-100, Photon System Instruments, Drásov, Czech Republic)를 이용하여 3 반복 측정하였다. 이때 측정된 엽록소 형광분석 매개변수는 JIP–Test (Stirbet and Govindjee, 2011)를 활용해 광생리지표 및 스트레스 지수를 산정하였다(Table 1) JIP 테스트는 광에너지의 흡수(ABS), 포획(TRO), 전자 전달(ETO), 소산(DIO), 광합성계I의 말단 수용체 환원(REO)과 활성화된 잎 단면적(CS)에 대한 최대 에너지 흐름(O)을 정의한다. FO는 초기형광으로 모든 반응 중심이 열려 있는 상태를 의미하고 FM는 최대 형광으로 모든 반응 중심이 닫힌 상태를 의미한다(Strasser et al., 2004).
2.4. 통계분석
통계분석은 R (V4.1.3; R Core Team 2021) 프로그램을 활용하여 엽록소 형광 매개변수와 군락온도를 p < 0.05수준으로 상관분석을 실시하였고 품종별 가온 하우스온도와 처리구간의 온도를 분산분석(ANOVA)을 p < 0.05 수준으로 수행하였으며, Duncan Test를 통한 다중검정을 실시하였다.
3. 결과 및 고찰
3.1. 가온하우스 및 군락온도
본 연구에서 5개 하우스 내 각 처리구의 연평균 최고 기온은 감평은 27.8℃, 남진해 27.9℃, 부지화 27.5℃, 신예감 30.7℃, 하례조생 27.4℃로 Duncan Test결과 품종 간에 유의한 차이는 나타나지 않았다. 가온 하우스에서 감귤 재배 기간 중 8월 6일에 모든 처리구에서 일평균 최고기온이 가장 높았으며, 이때 T1 이 40.1℃, T2는 38.6℃, T3 36.9℃, 그리고 외부 기온은 33.9℃로 확인되었다. 온도처리구별 기온이 가장 높은 8월의 일평균 최고기온(5개 하우스 평균)을 다중검정한 결과, T1이 34.2℃(a)로 가장 높았고 T2 32.8℃(b), T3 30.6℃(c), 외부 기온 28.2℃(d)로 처리구간에는 유의적인 차이가 있는 것으로 확인되었다(Fig. 2). 감귤은 엽온이 30℃ 내외의 고온일 경우 온도가 높아짐에 따라 광합성량이 크게 감소하는 것으로 보고되어 본 연구의 가온 처리구에서 외부 기온에 비해 엽온이2℃ 이상 높은 것으로 확인되어 생육기간 중 광합성 저해가 발생할 것으로 예상되었다(Kang et al., 2017).
3.2. 엽록소 형광량(OJIP) 분석
가온 처리한 감귤의 초기 엽록소 형광량에 대한 광화학 기구 간 에너지 연계성 및 그룹화(△VOK)를 분석한 결과 O-K 전이 단계(0~0.3 ms)의 엽록소 형광량은 부지화를 제외한 모든 품종의 T1 처리구에서 증가하는 것으로 확인되었다(Fig. 3).
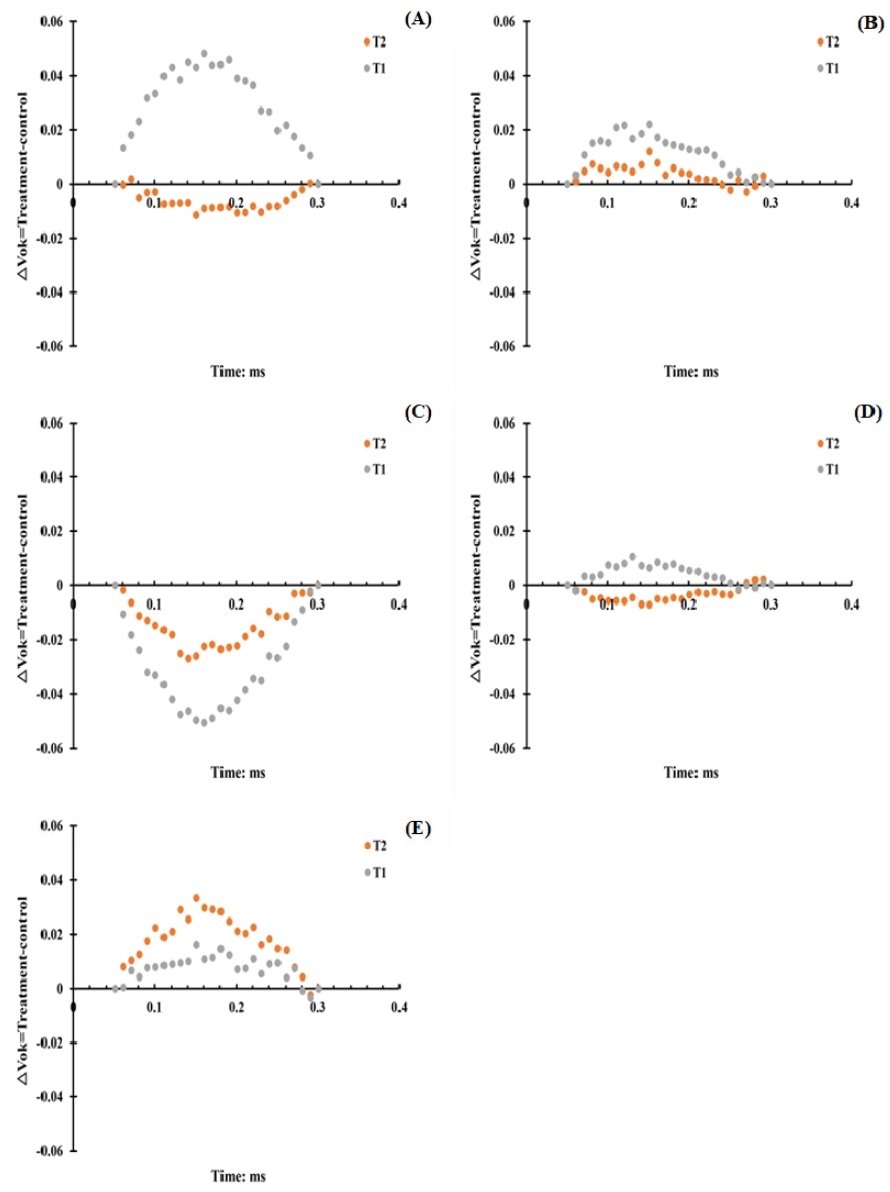
Comparison of △Vok (relative variable fluorescence between O to K steps) of citrus trees in greenhouses by heating treatment temperature (A) Kanpei; (B) Natsumi; (C) Shiranuhi; (D) Sinyegam; (E) Marcow.
초기 엽록소 형광 방출량(O-J) 사이에 확인된 새로운 밴드인 K는 광합성계 II 여기 에너지 전달에 의해 영향을 받아 환경 스트레스에 의한 광화학 기구의 활성 저해를 평가할 수 있다(Strasser and Stirbet 1998; Oukarroum et al., 2007; Ioannidis et al., 2009). 식물은 고온 스트레스를 받으면 광합성계 II의 광수확복합체(LHC)가 틸라코이드막에서 분리되어 전자전달이 억제되고 산소발생복합체(OEC) 및 반응중심(RC) 손상과 엽록소 생합성 저해와 분해가 발생하게 된다(Mlinarić et al., 2023). 본 연구 결과와 유사하게 사과나무와 모란 잎에서 고온 스트레스에 의해 최대 형광량 감소와 O-K-J 전이 단계의 엽록소 형광량이 증가하는 것으로 보고되었다(Ji et al., 2022; Mihaljević et al., 2024). 고온 스트레스로 인한 O-K-J 전이 단계의 엽록소 형광량 증가는 산소발생복합체의 손상으로 물 분해를 통한 전자 전달이 어려워지고 광합성계 II 공여체(QA)에서 QB 로의 전자전달 감소가 발생하여 QA의 전자 축적으로 인해 결국 광합성계 I 전자 수용체까지의 전자 수송 능력이 감소하는 것으로 보고되었다(Strasser et al., 2004). T2 처리구에서 남진해와 하례조생은 O-K 전이 단계의 엽록소 형광량이 증가가 확인되어 상대적으로 낮은 온도에서부터 고온 스트레스를 받을 수 있을 것으로 판단되었다. 그리고 T1 처리구에서는 부지화를 제외한 모든 품종의 O-K 전이단계의 엽록소 형광량이 증가했으며, 외부기온 대비 +6℃이상의 고온 환경에 지속적으로 노출될 경우 잎의 광합성계 II 활성이 저하되어 전자전달 효율이 감소하는 것으로 판단되었다. 부지화는 고온에 강한 품종이라는 연구결과(Kim et al., 2022)와 같이 T1 처리구에서도 광화학기구의 활성 저해가 발생하지 않아 고온에 강한 품종으로 판단되었다.
3.3. 광화학적 생리지표 분석
광화학적 생리지표는 T3 처리구를 기준으로 가온 처리에 따른 감귤의 엽록소 형광 매개변수를 T1, T2 처리구를 T3 처리구로 나누어서 비교하였다(Fig. 4). 단면적당 활성화된 반응중심(RC/CS)은 T1 처리구의 4개 품종(감평, 신예감, 남진해, 하례조생)에서 T3 처리구 대비 감소하였으며, T2 처리구는 남진해에서만 감소가 나타났다. T2 처리구의 남진해는 단면적당 활성화된 반응중심(RC/CS)이 감소하여 광합성계 I, II 전자전달 에너지 플럭스(ET2o/CS, RE1o/CS)도 감소되었다. 이러한 결과는 온도 상승에 따라 배추의 ABS/CS, TRo/CS, ET2o/CS가 감소하여 광합성계 II에서의 에너지 플럭스가 감소한 결과와 일치하였다(Yan et al., 2012; Oh et al., 2014). T2 처리구의 하례조생은 광합성계 II 반응중심(PSII RC)의 활성 저하로 인해 광에너지 손실률(DIo/RC)이 증가하여 광합성계 II에서의 에너지 플럭스(ABS/RC, TRo/RC)가 원활하지 못한 것으로 판단되었다. 반면 감평과 신예감은 T1 처리구에서만 광에너지 손실률 증가와 단위면적당 에너지 플럭스의 감소가 발생하여 남진해와 하례조생보다는 고온에 강한 것으로 판단되었다. 부지화는 T1, T2 처리구에서 RC/CS, ABS/CS, TRo/CS 및 ETo/CS 등 엽록소 형광 매개변수의 증가가 나타남에 따라 고온에 의한 광합성능의 감소는 없을 것으로 판단되었다.
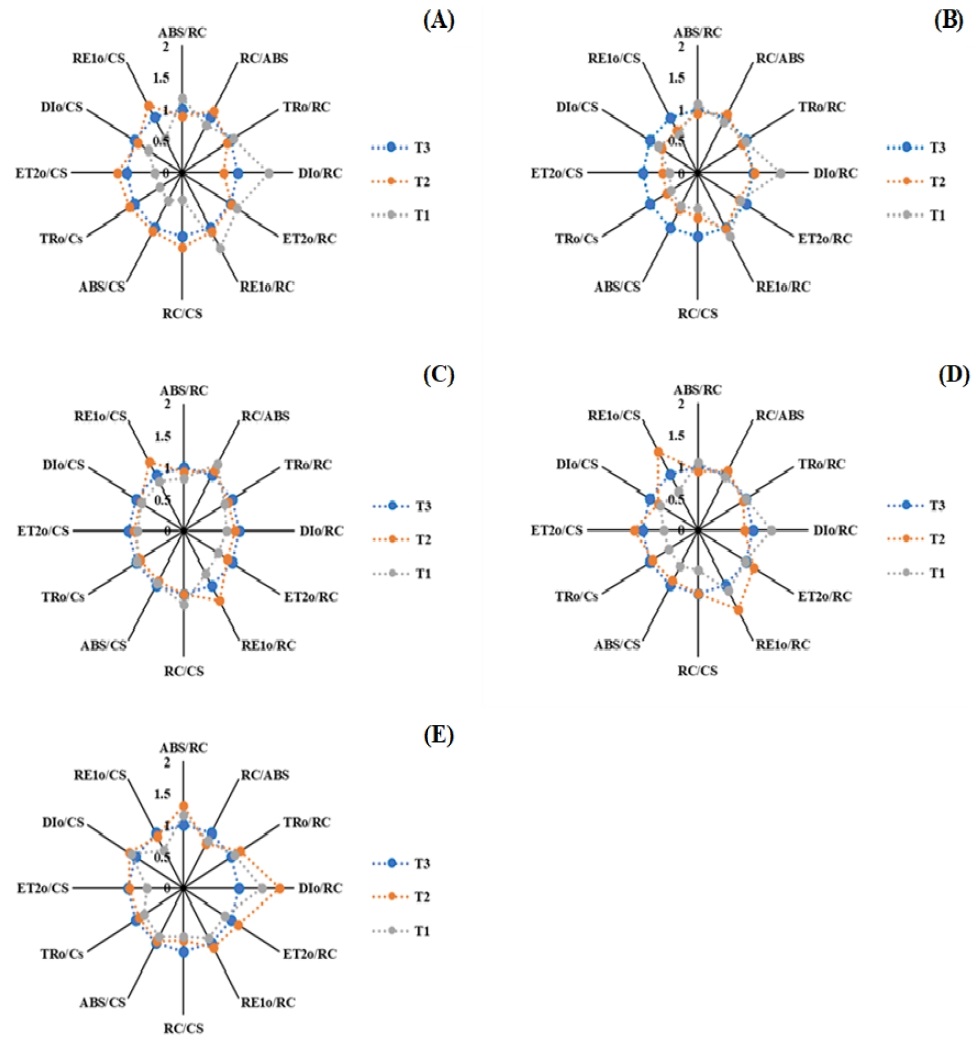
Comparison of energy flux of citrus trees in greenhouses by heating treatment temperature (A, Kanpei energy flux; B, Natsumi energy flux; C, Shiranuhi energy flux; D, Sinyegam energy flux; E, Marcow energy flux, Other Treatment / T3 Treatment).
온도와 엽록소 형광매개변수의 상관분석을 통해 총 8개(DIo/RC, PI ABS, RC/CS, ABS/CS, TRo/CS, ET2o/CS, DIo/CS, RE1o/CS)의 고온 스트레스 광생리지표가 선발되었다(Fig. 5).
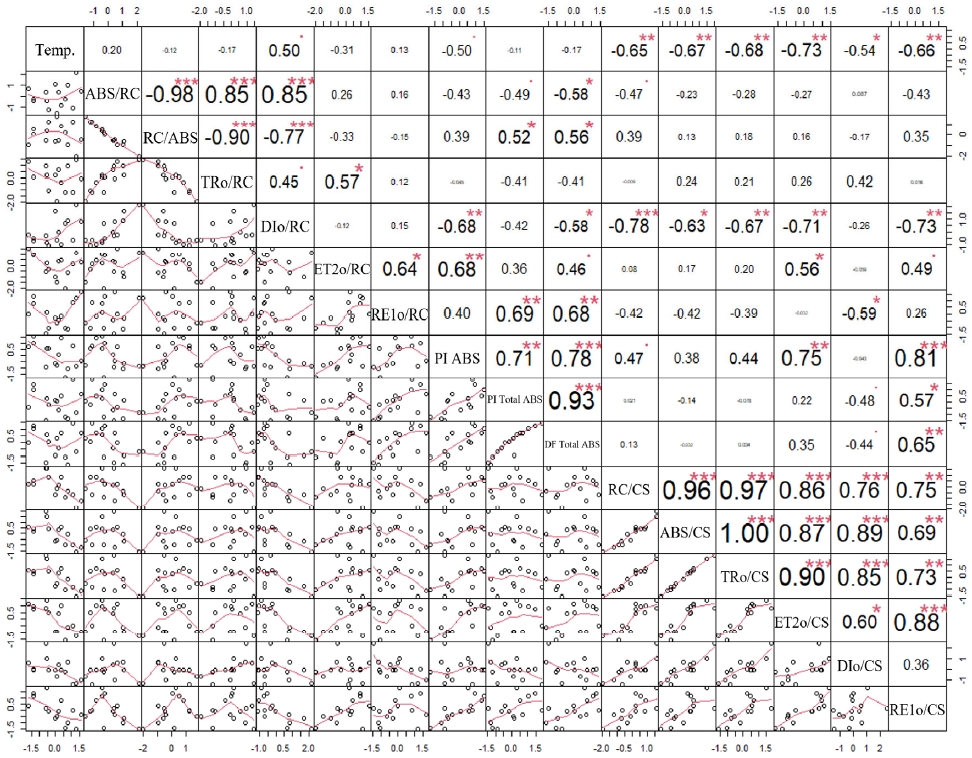
Correlation analysis between OJIP indices and temperature for heat stress evaluation of citrus fruits (* p < 0.05, ** p < 0.01, *** p < 0.001).
PSII의 비활성화 및 손상을 평가할 수 있는 PI ABS는 환경 스트레스에 민감한 지표로, 고온 스트레스를 받았을 때 감소하는 것으로 알려져 있다(Yan et al., 2011). 따라서 PI ABS 지표를 활용하여 고온 스트레스지수(Heat stress factor index, HSFI)산정하여 스트레스 내성 품종 선발에 활용하였다(Oukarroum et al., 2007). 신예감과 부지화는 고온 내성이 가장 높은 I 그룹(HSFI ≥ 0)으로 분류되었으며, 감평은 II 그룹(HSFI ≥ - 0.5), 하례조생과 남진해는 고온에 약한 III 그룹(HSFI < - 0.5)으로 평가되었다(Fig. 6).
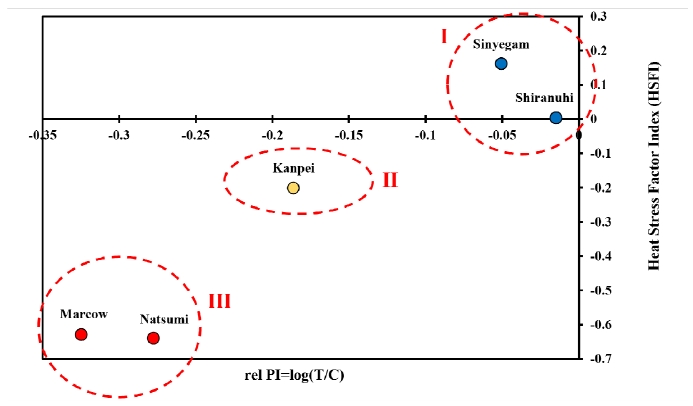
Assessment of photosynthetic system performance of citrus fruit under heat stress using the Heat Stress Factor Index (HSFI=log(A)+2log(B), A = T2 PI/T3 PI, B = T1 PI/T3 PI).
본 연구의 HSFI를 활용한 고온 내성 등급화 결과는 부지화가 하례조생보다 고온에 강한 품종이라는 연구결과와 일치하였다(Kim et al., 2022). 결론적으로 엽록소 형광 반응 분석을 이용해 감귤의 고온스트레스를 정량적으로 평가하여 내성 품종 선발이 가능하였으며, 감귤의 적정 온도 구명을 통한 가온 재배기술에 기초자료로 활용 가능할 것으로 사료되었다.
4. 결 론
본 연구는 가온 재배 감귤의 광합성 기구의 전자전달 효율을 분석하여 고온 내성 품종 선발에 활용할 수 있는 광생리지표를 선발하기 위해 감귤재배 가온하우스에서 실시하였다. LogPI ABS로 계산한 HSFI와 식물의 고온스트레스를 평가하는 지표로 사용되고 있는 K-band는 보리 품종간의 광합성계 II의 열내성을 평가하는데 유용한 지표로 활용되었다(Oukarroum et al., 2016). 두 지표를 활용하여 분석한 결과, T2 처리구에서 남진해와 하례조생은 O-K 전이 단계에서 엽록소 형광량이 증가하여 광합성 기구의 손상이 발생한 것으로 판단되었고 PI ABS를 활용한 고온스트레스 지수분석에도 고온 내성이 가장 낮은 III그룹으로 평가되어 고온에 약한 품종인 것으로 확인되었다. T1 처리구에서는 부지화를 제외한 모든 품종이 고온스트레스를 받아 외부기온 대비 +6℃에서는 대부분의 품종이 스트레스를 받는 것으로 확인되었다. 그러나 부지화는 가온 처리에 의한 최대형광량 및 O-K 전이단계(△VOK)의 변화가 없었고 T1, T2 처리구에서 RC/CS, ABS/CS, ETo/CS 등 엽록소 형광 매개변수가 증가하여 고온에 의한 광합성능의 감소가 없는 것으로 판단되어 고온에 강한 품종으로 확인되었다. 결론적으로, 본 연구는 엽록소 형광 반응 분석을 이용해 감귤의 고온스트레스를 정량적으로 평가함으로써 내성 품종 선발과 품종별 적정 온도 구명을 통한 가온 재배기술에 활용할 수 있다. 그러나 국내에서 재배되는 감귤 품종마다 고온에 대한 내성이 다르기 때문에, 다양한 품종의 내열성을 비교하고 평가하는 연구가 필요한 것으로 보인다. 또한 기후변화를 대비하여 품종별 감귤 재배지의 기후 모델링 등 고온스트레스에 대비하는 것이 향후 연구의 중요한 과제가 될 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: RS-2021-RD009681)의 일부 지원으로 이루어진 것입니다.
REFERENCES
-
Abobatta, W. F., 2019, Influence of climate change on citrus growth and productivity (effect of temperature). Adv Agric Technol Plant Sci, 2(4), 308-312.
[https://doi.org/10.15406/mojes.2019.04.00168]

-
Ahn, S. Y., Kim, S., Moon, Y. E., Yun, H. K., 2016, Gene expression as related to ripening in high temperature during different coloration stages of 'Haryejosaeng' and 'Shiranuhi' mandarin fruits, Horticul Sci & Technol, 34(5), 665-676.
[https://doi.org/10.12972/kjhst.20160070]

-
Ge, Z. M., Zhou, X., Kellomäki, S., Peltola, H., Martikainen, P., Wang, K. J. P., 2012, Acclimation of photosynthesis in a boreal grass (Phalaris arundinacea L.) under different temperature, CO2 and soil water regimes, Photosynthetica, 50, 141-151.
[https://doi.org/10.1007/s11099-012-0014-x]

-
Ioannidis, N. E., Ortigosa, S. M., Veramendi, J., Pintó-Marijuan, M., Fleck, I., Carvajal, P., Torné, J. M., 2009, Remodeling of tobacco thylakoids by over-expression of maize plastidial transglutaminase, Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1787(10), 1215-1222.
[https://doi.org/10.1016/j.bbabio.2009.05.014]

-
Ji, W., Luo, H., Song, Y., Hong, E., Li, Z., Lin, B., Fan, C., Wang, H., Song, X., Jin, S., Chen, X., Zhu, X., 2022, Changes in photosynthetic characteristics of Paeonia suffruticosa under high temperature stress. Agronomy, 12(5), 1203.
[https://doi.org/10.3390/agronomy12051203]

- Kang, S. B., Moon, Y. G., Lee, H. J., Choi, Y. H., 2017, Fruit quality and tree growth of ‘Shiranuhi’ mandarin hybrid under abnormal high temperature in the daytime, Korean J. Environ. Agric., 42(4), 145-145.
-
Kim, M. S., Moon, Y. I., Kim, S. S., Jwa, J. H., Yoon, S. G., Park, J., 2022, The impact of long-term temperature rise on water body growth and fruit quality in facility cultivation ‘on-site’, Korean J. Environ. Agricul, 41(4), 318-327.
[https://doi.org/10.5338/KJEA.2022.41.4.37]

- Kitazono, K., Kawakubo, Y., Fujita, K., 2012, Effects of global warming on cultivation of Satsuma Mandarin in Kumamoto prefecture, Research Bulletin of the Kumamoto Prefectural Agricultural Research Center, 19, 1-17.
-
Mihaljević, I., VULETIĆ, M. V., Tomaš, V., Zdunić, Z., Vuković, D., 2024, Photosynthetic responses of heat-stressed apple leaves to foliar application of salicylic and ascorbic acid, Photosynthetica, 62(1), 79-89.
[https://doi.org/10.32615/ps.2024.006]

- Mlinarić, S., Begović, L., Katanić, Z., Galić, V., 2023, Changes of chlorophyll a fluorescence parameters influenced by light and temperature stress, Chlorophyll a fluorescence measurements in croatia· first twenty years, 29.
-
Moon, K. H., Son, I. C., Song, E. Y., Oh, S., Park, K. S., Hyun, H. N., 2015, Quantification of environmental characteristics on citrus production area of Jeju Island in Korea, Korean J. Agricultural and Forest Meteorology, 17(1), 69-74.
[https://doi.org/10.5532/KJAFM.2015.17.1.69]

-
Moon, Y. E., Kang, S. B., Han, S. G., Kim, Y. H., Choi, Y. H., Koh, S. C., 2015, Effects of elevated spring temperatures on the growth and fruit quality of the mandarin hybrid ‘Shiranuhi’, Horticultural Science & Technology, 33(4), 459-469.
[https://doi.org/10.7235/hort.2015.14190]

- Moon, Y. E., Kang, S. B., Lee, H., Choi, Y. H., Son, I. C., Lee, D. H., An, M. I., 2017, Projection of potential cultivation region of Satsuma mandarin and 'Shiranuhi'mandarin hybrid based on RCP 8.5 emission scenario, Korean J. Agricultural and Forest Meteorology, 19(4), 215-222.
-
Oh, S., Moon, K. H., Son, I. C., Song, E. Y., Moon, Y. E., 2014, Growth, photosynthesis and chlorophyll fluorescence of Chinese cabbage in response to high temperature, Horticultural Science and Technology, 32(3), 318-329.
[https://doi.org/10.7235/hort.2014.13174]

-
Oukarroum, A., El-Madidi, S., Schansker, G., Strasser, R. J., 2007, Probing the responses of barley cultivars (Hordeum vulgare L.) by chlorophyll a fluorescence OLKJIP under drought stress and re-watering, Environmental and Experimental Botany, 60(3), 438-446.
[https://doi.org/10.1016/j.envexpbot.2007.01.002]

-
Oukarroum, A., El Madidi, S., Strasser, R. J., 2016, Differential heat sensitivity index in barley cultivars (Hordeum vulgare L.) monitored by chlorophyll a fluorescence OKJIP. Plant Physiol and Biochem, 105, 102-108.
[https://doi.org/10.1016/j.plaphy.2016.04.015]

-
Papageorgiou, G. C., Govindjee., 2004, Chlorophyll a fluorescence a signature of photosynthesis. (Eds.) Advances in photosynthesis and respiration, Springer, 19, 818
[https://doi.org/10.1007/978-1-4020-3218-9]

- R Core Team, 2021, R: A Language and environment for statistical computing, R foundation for Statistical Computing, Vienna, Austria, https://www.R-project.org/, , Accessed March 21, 2024.
-
Stirbet, A., Govindjee., 2011, On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem II: Basics and applications of the OJIP fluorescence transient, J. Photochemistry and Photobiology B: Biology, 104(1-2), 236-257.
[https://doi.org/10.1016/j.jphotobiol.2010.12.010]

-
Strasser, R. J., Stirbet, A. D., 1998, Heterogeneity of photosystem II probed by the numerically simulated chlorophyll a fluorescence rise (O–J–I–P), Mathematics and Computers in Simulation, 48(1), 3-9.
[https://doi.org/10.1016/S0378-4754(98)00150-5]

-
Strasser, R. J., Tsimilli-Michael, M., Srivastava, A., 2004, Analysis of the chlorophyll a fluorescence transient. In Chlorophyll a fluorescence: A Signature of photosynthesis, Springer, 321-362.
[https://doi.org/10.1007/978-1-4020-3218-9_12]

-
Strauss, A. J., Krüger, G. H. J., Strasser, R. J., Van Heerden, P. D. R., 2006, Ranking of dark chilling tolerance in soybean genotypes probed by the chlorophyll a fluorescence transient OJIP, Environmental and experimental botany, 56(2), 147-157.
[https://doi.org/10.1016/j.envexpbot.2005.01.011]

-
Yan, K., Chen, P., Shao, H., Zhang, L., Xu, G., 2011, Effects of short‐term high temperature on photosynthesis and photosystem II performance in sorghum, J. Agronomy and Crop Science, 197(5), 400-408.
[https://doi.org/10.1111/j.1439-037X.2011.00469.x]

-
Yan, K., Chen, P., Shao, H., Zhao, S., Zhang, L., Zhang, G., 2012, Responses of photosynthesis and photosystem II to higher temperature and salt stress in Sorghum, J. Agronomy and Crop Science, 198(3), 218-225.
[https://doi.org/10.1111/j.1439-037X.2011.00498.x]

Department of Plant Resources and Landscape Architecture, Hankyong National University ymh5240@naver.com
Department of Plant Resources and Landscape Architecture, Hankyong National Universityozoz_02@naver.com
Department of Plant Resources and Landscape Architecture, Hankyong National Universityhybb0412@hknu.ac.kr
Institute of Ecological Phytochemistry, Hankyong National Universitylsn136@hknu.ac.kr
Department of Fruit Science, Korea National University of Agriculture and Fisheries talkung@korea.kr
Citrus Research Institute, National Institute of Horticultural and Herbal Science, RDA jeespark@korea.kr
Department of Plant Resources and Landscape Architecture, Hankyong National Universitytaewkim@hknu.ac.kr