
육묘기 저온 처리가 ‘설향’ 딸기의 화아분화 감응과 과실 수량에 미치는 영향
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study examined the effects of low-temperature treatment during the nursery period on flower bud differentiation, flowering time, and early yield in the ‘Seolhyang’ strawberry cultivar. Strawberry runner tips were cut on June 10 and subjected to flower differentiation treatments on August 7 in a growth chamber at 17°C, 20°C, 25°C, and 20°C/25°C with a 13/11-h (day/night) photoperiod. The progression of flower bud differentiation was subsequently assessed. Low-temperature–treated nursery plants were transplanted on September 9 into elevated beds for hydroponic cultivation, and flowering time and fruit productivity were investigated. Flower bud differentiation was the fastest at 20°C and 20°C/25°C, reaching stage 3 within 12–16 days, whereas plants treated to 25°C and control reached stage 2 only after 32 days. Flowering began on October 15 for the plants treated to 20°C, 16 days earlier than in the control. The first harvest occurred on November 11 in plants treated to 17°C and 20°C, 18 days earlier than in the control. The 20°C treatment produced 4.4 and 8.3 fruits in November and December, compared with 1.3 and 5.5 in the control, respectively; however, control fruits were heavier, averaging 37.1 and 27.5 g in November and December, respectively. The 20°C treatment yielded the highest early fruit production, with 79.2 and 104.0 g in November and December, respectively. In the control, the yield increased in January, with the total yield in the first flower cluster being 211.0–221.9 g and no significant difference observed among treatments. The fruit yield in the second flower cluster was 244.6 g for the 20°C treatment, compared to 168.6 g for the control.
Keywords:
Crown, Flower cluster, Flower time, Growing point, Harvest period, Microphotogrph1. 서 론
우리나라의 딸기(Fragaria × anassa Duch.) 재배는 대부분 일계성 품종을 사용하여 촉성재배 하고 있으며, 10월 하순부터 다음 해 5월까지 수확한다. 촉성재배는 화아분화가 빠른 품종을 선택해야 하고 육묘 후반기에는 화아분화 촉진을 위해 인위적인 환경 처리를 해 주어야만 조기 수확이 가능하다. 일계성 딸기 품종은 저온과 단일 조건에서 화아분화를 유도하게 되는데, 온대 과수와 유사하게 늦여름이나 초가을부터 관부 정단분열조직의 생장점이 화아로 분화하게 된다(Eguchi, 1932). 딸기 육묘는 6월부터 8월까지 여름의 고온과 장일 조건에서 진행되는데 이 시기의 환경요인으로 인해 화아분화가 불안전하거나 늦어지는 경우가 많다. 화아분화가 완료되지 않는 상태의 묘를 정식하면 식물체는 영양생장을 지속하면서 출뢰가 불안정하고 개화와 수확이 늦어진다(Hwang, 2010; Yoshida et al., 2012). 자연조건에서 화아분화기는 9월 20일 전·후로 알려져 있으며(Ito and Saito, 1962), 8월 하순부터 9월 상순에 정식하는 촉성재배에서는 육묘 후반기에 차광이나 질소 중단 등의 인위적인 화아분화 촉진 방법을 처리한 후 정식 한다.
딸기의 화아분화는 온도가 주요인으로 작용하고, 단일 조건에서 촉진되며, 이러한 조건하에서도 체내 질소 함량이 낮을수록 화아유도에 효과가 있다. 화아형성은 일장에 관계없이 12∼14℃에서 가장 안전하게 유도되고, 30℃ 이상의 고온에서는 짧은 일장에서도 화아형성이 되지 않고, 17∼24℃ 범위에서만 단일성 식물처럼 반응한다(Darrow and Waldo, 1937; Ito and Saito, 1962). 우리나라 8월 중·하순의 주간 온도는 30℃ 이상 고온으로 유지되고, 야간에도 25℃ 이하로 내려가지 않아 안정적인 화아분화 유도에 어려움이 많다. 이런 환경을 극복하기 위해 고랭지 육묘가 일부 지역에서 진행되었으나, 이동성에 따른 육묘장의 관리, 작업 효율성 등의 문제로 확산되지 못 하였다. 평난지의 딸기 재배 지역에서는 고온기에도 화아분화를 안정적으로 유도하기 위해 온도 제어 시스템을 개발하였고(Mukai and Ogura, 1988; Kim et al., 1999; Ikeda et al., 2007; Miyoshi et al., 2013; Choi et al., 2023), 저온 암흑처리가 화아분화를 촉진시키는데 효과적이었다고 보고하였다(Jun et al., 2013). 딸기는 저온성 작물로 분류되는데 최근 환경변화와 지구 온난화 등으로 인해 안정적인 화아 유도가 어려운 환경조건에 놓여있다. 촉성재배에 있어서 화아분화 시기를 결정하는 것은 안정적인 딸기 생산에 있어서 매우 중요한 과정이다. 본 연구는 저온 처리 방법을 통해 촉성 재배용 ‘설향’ 딸기 품종의 화아분화 특성, 개화기 및 조기 수량에 미치는 영향을 조사하였다.
2. 재료 및 방법
본 연구는 우리나라 딸기 재배면적의 85%을 차지하고 있는 ‘설향’(Fragaria ⅹ ananassa Duch. cv. Seolhyang) 품종을 사용하여, 경상국립대학교 종합농장 딸기 전용 육묘장과 유리 온실에서 2023년 6월 1일부터 2024년 3월 31일까지 수행하였다. 딸기 묘는 2023년 6월 10일 혼합상토(펄라이트 40%, 코코피트 60%, 참존, 호현바이오, 대한민국)를 채운 딸기 전용 육묘 트레이(지그포트 27, 대승, 대한민국)에 고정핀으로 삽수를 고정시켜 삽목하였다. 삽수는 육묘용 모주에서 발생한 런너를 채취한 후 잎 2매 남기고 조제하였다. 삽목 후 2주 동안은 소형 터널 외부에 투명 PE 비닐(0.05 mm, 남진비니루, 대한민국)을 씌워서 삽목 상의 공중습도를 95% 이상 유지되도록 에어포그 시스템(CP 500, 해강 삼우, 대한민국)으로 가습하였고, 주·야간 온도는 25℃ 유지되도록 하였다. 삽목 2주 후에 삽수의 뿌리가 완전히 활착된 후 소형 터널의 PE 비닐을 제거하였고, 7월 상순부터 8월 초순까지는 경남농업기술원 딸기양액 처방서에 따라 배양액을 조제한 후 EC 0.8 dS·m-1, pH 6.0으로 설정한 자동 양액공급기(SH-2000, 신한에이텍, 대한민국)를 사용하여 매일 3회 3분간 공급하였다. 삽목 이후 육묘장에서 관리한 묘는 2023년 8월 7일 처리 당 100주씩 식물 생장상(SH-76BL, Seyoung Scientific Co., Korea)으로 옮겨서 9월 9일까지 온도를 처리하였다. 화아분화 유도 처리 온도는 17℃, 20℃, 25℃, 20/25℃(야간/주간)로 4처리를 하였고, 일장은 13/11(주간/야간)시간 동일한 조건으로 250 μmol·m-2·s-1 광량의 LED 광원에서 수행하였다. 처리 기간 중에는 묘가 마르지 않도록 매일 주당 30 mL씩 관주 하였고, 대조구와 같이 주 2회 EC 0.8 dS·m-1 농도로 양액을 공급하였다. 대조구는 딸기전용 고설베드 육묘장에서 자연조건의 온도와 일장 상태로 관리하였고, 주간 온도는 29.4∼36.1℃, 야간 온도는 21.9∼30.2℃ 범위였다(Fig. 2). 처리 기간은 8월 7일부터 9월 9일까지 진행하였다. 온도와 일장을 처리한 이후 4일 간격으로 처리 당 7개체씩 화아분화 과정을 실체 현미경(SZ-51, Olympus, Japan)으로 검경하였다. 화아분화 단계는 0단계(미분화기)부터 5단계(꽃받침 형성기)까지 총 6단계로 나누어 판정하였다(Hidaka et al., 2017). 0단계는 미분화기로 생장점이 잎눈으로 분화한 상태, 1단계는 화아분화 초기 1단계로 생장점이 돌출되면서 변화를 시작하는 단계, 2단계는 화아분화 초기 2단계로 변화된 생장점이 비대하는 단계, 3단계는 화아분화기로 생장점이 비대하여 2개로 분할되는 상태, 4단계는 화방분화기로 1, 2번 꽃이 분할된 상태 그리고 5단계는 꽃받침이 형성되는 시기로 판정하였다(Fig. 1).
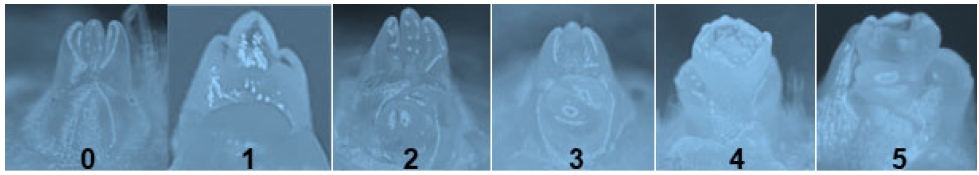
Microphotograph of the flower bud differentiation stage of apical meristem in the crown. Flower bud development was classified into 6 stages(0 to 5). 0, the vegetative apex stage; 1, the early apex enlargement stage; 2, the middle apex enlargement; 3, the apex division; 4, the flower cluster development stage; 5, the sepal development stage.
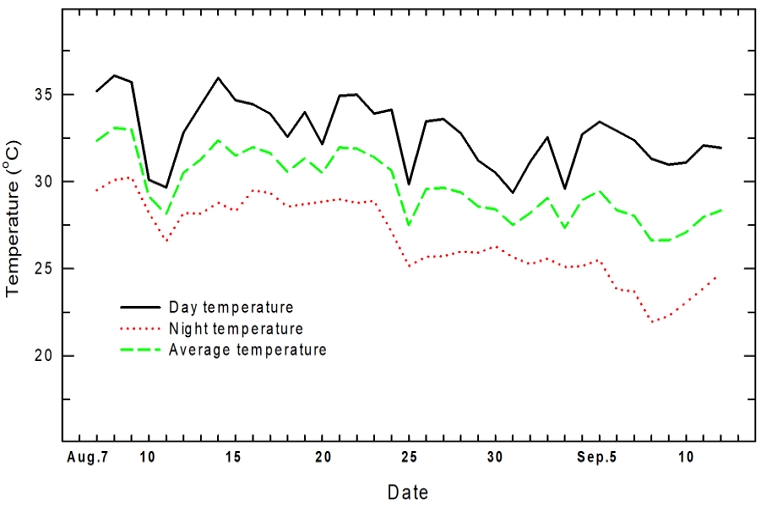
Changes in day, night and average temperature in nursery bed during strawberry flower bud differentation time.
딸기 재배는 유리 온실 내 수경재배용 고설 베드에 혼합상토를 채운 후 처리 별로 주간 18 cm 간격, 20개체씩 2반복으로 9월 9일에 정식하였다. 양·수분 관리는 경남농업기술원 딸기양액 처방서에 따라 배양액을 조제한 후 EC 0.8∼1.0 ds·m-1, pH 6.0 설정하여 개체당 50 mL씩 매일 5∼7회 자동양액 공급기(IL/Netajet, 네타핌, 이스라엘)를 사용하여 급액하였다. 온실 내 온도는 주간 20∼25℃, 야간 최저 10℃로 관리하였고, 일반 재배 및 관리는 딸기 수경재배 표준 매뉴얼에 따라 환경을 관리하면서 재배하였다. 개화기는 1화방 1번 꽃이 개화한 날을 평균값으로 표시하였고, 과실은 꽃받침 아래 부분까지 80% 정도 붉게 착색되었을 때 1주일에 2∼3회 수확하였다. 수확한 과실은 과실 수, 과중, 과실 수량을 조사하였다. 과실 수량은 1∼2화방을 대상으로 11월부터 3월까지 수확하여 무게를 측정한 후 식물체 1개체당 g 단위로 표시하였다.
자료의 통계분석은 SAS 프로그램(SAS 9.4, SAS Institute Inc., Cary, NC, USA)을 이용하여 분산분석하였고, 처리 평균간 비교는 덩컨다중 검정(Duncan’s multiple range test) 방법으로 5% 유의수준에서 검증하였다. 그래프는 SigmaPlot 프로그램(SigmaPlot 12.5, Systat Software Inc, San Jose, CA, USA)을 이용하여 나타냈다.
3. 결과 및 고찰
Fig. 2는 딸기 화아분화 기간인 8월 7일부터 9월 12일까지 육묘장 내 주간, 야간 온도와 평균 온도를 조사하였다. 주간 온도는 9월 상순까지 30℃ 이상 고온이 유지되었고, 야간 온도는 8월 25일이 지난 후에 딸기 화아분화 한계온도인 25℃ 전·후까지 점차적으로 낮아졌다. 평균 온도는 26.6∼33.1℃로 화아분화 한계온도 이상이었다.
Fig. 3과 Fig. 4는 저온 처리별로 묘의 화아분화 진행단계를 실체 현미경을 통해 검경한 결과이다. 8월 19일(처리 후 12일) 검경에서 20℃ 처리는 화아분화 초기 1.5단계로 가장 빠르게 분화를 하였지만, 다른 처리구는 0.5단계로 화아분화 진행단계를 판정하기 어려웠다. 8월 23일(처리 후 16일)은 20℃와 25/20℃에서 화아분화 3단계까지 진행되면서 화아가 2개로 분할하는 단계까지 발달하였고, 17℃에서는 화아분화 초기 1.7단계 수준이었다. 8월 27일(처리 후 20일)의 20℃ 처리는 화아분화 4.3단계로 화방이 분화하는 단계까지 발달하였으며, 17℃와 25/20℃ 처리구는 각각 2.2단계, 2.9단계였고, 25℃와 대조구는 0.5단계 수준으로 분화가 늦었다. 20℃에서는 저온 처리 후 12일, 17℃와 25/20℃에서는 처리 후 16일이 경과되면서 화아분화가 진행되는 것을 확인하였다. 그러나 25℃는 처리 후 32일이 경과되면서 생장점의 변화가 있었고, 대조구는 9월 1일이 되어서 화아분화 초기 1.1단계 수준이었다. Hwang(2010)은 ‘설향’ 품종의 육묘기 저온 처리 연구에서 20일이 경과되면 15℃와 20℃는 화아분화 2단계로, 10℃는 3단계로 분화가 되었는데, 온도가 낮고 처리 기간이 길수록 촉진되었다. 본 연구에서 17℃ 처리는 20일 경과한 후 화아분화 2.2단계 수준으로 이전 연구(Hwang, 2010; Jun et al., 2013)와 유사한 결과를 보였다. 그러나 17℃는 20℃ 또는 20℃/25℃ 보다 초기의 분화 속도가 늦지만, 처리 24일 이후에는 4.5단계 수준으로 20℃ 처리와 같았다. 야간 17°C 와 일장 11시간에서 화아분화에 필요한 처리 일수는 21일∼23일(Austin et al., 1961), 17°C 온도와 8시간 일장에서는 8일 처리하면 화아분화가 되었는데(Ito and Saito, 1962), 처리 전 묘의 생육과 품종에 따라 화아분화에 차이를 보이기도 하였다. 딸기 육묘기 야간 12℃와 일장 8시간 처리에서 ‘Nyoho’, ‘Toyonoka’, ‘Harunoka’ 품종은 15일 후에 화아를 형성하였고, ‘Haruyoi’ 품종은 20일, ‘Chiyoda’ 와 ‘Yachiyo’ 품종에서는 20일이 되어도 화아를 형성하지 못하였다(Morishita and Yamakawa, 1991). 동일한 품종이지만 일부 지역에서는 개화가 지속되는 반면, 다른 지역에서는 불안전하게 개화를 하였고(Durner et al., 1984), 같은 지역에서도 개화 속도는 다양하였다(Bradford et al., 2010). 딸기 화아분화기에 26℃ 전·후의 고온에서 일계성 ‘Chandler’ 품종은 포트 크기, 묘령, 광주기와 관계없이 모두 개화가 억제되고(Zhang et al., 2001), 사계성 딸기 품종에서도 개화가 억제되었는데(Smeets, 1980; Durner et al., 1984), 이는 본 연구의 25℃ 처리 결과와 유사하였다. ‘설향’ 딸기는 육묘기 20℃ 전·후의 온도 조건에서 20∼24일 경과 되어야 안정적으로 3단계 이상 화아분화가 되었고, 25℃는 화아분화 한계온도라는 것을 확인할 수 있었다.
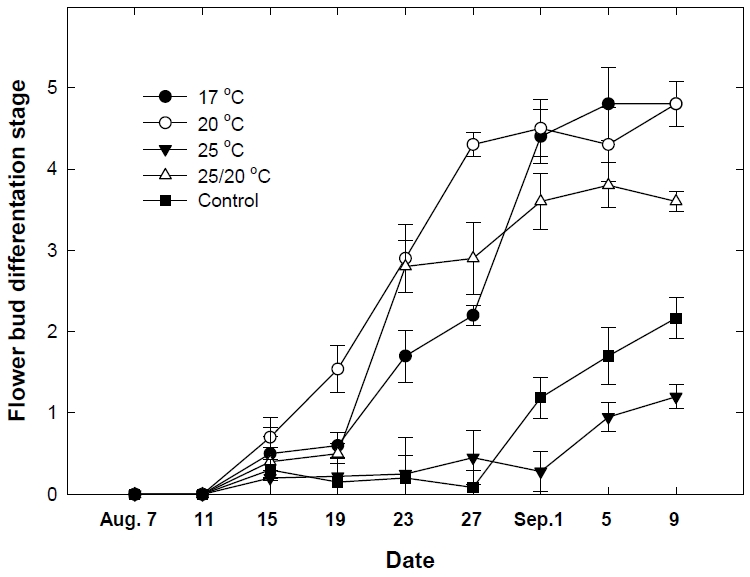
Changes in flower bud differentiation stage according to low temperature treatment of strawberry nursery plants. Vertical bars represent standard deviation (n=7).
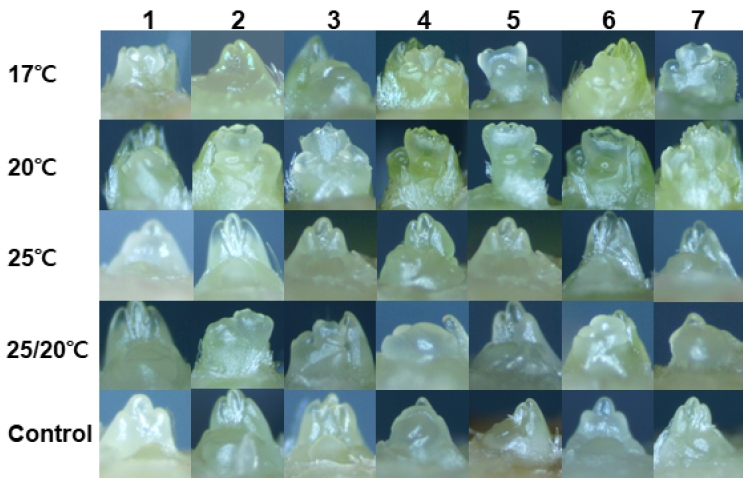
Microscopic view of flower bud differentiation progress stage after 28 days according to low temperature treatment of strawberry nursery plants. Seven nursery plants were examined per treatment on Sep. 9, 2024.
식물 생장상에서 30일간 저온 처리한 묘는 9월 9일 딸기 재배용 고설베드에 정식하여 개화기와 과실 수확기를 조사하였다(Table 1). 개화기는 20℃ 처리에서 10월 15일로 대조구 11월 1일보다 16일 빨리 개화하였다. 1화방 수확은 17℃와 20℃ 처리에서 11월 11일부터 첫 수확을 하였고, 대조구는 11월 29일 수확을 시작하여서 17℃, 20℃ 처리보다 18일 늦었다. 2화방은 17℃, 20℃ 처리에서 각각 1월 28일부터 첫 수확을 시작하여 3월 13일과 3월 11일까지 수확하였으며, 대조구는 2월 1일부터 3월 15일까지 수확하였다. 1화방은 20℃와 17℃ 처리에서 개화와 수확이 빨랐지만, 2화방에서는 처리별로 수확 기간에 큰 차이가 없었다. 본 연구에서는 저온 처리 후 9월 9일에 정식을 하였는데, 20℃와 25/20℃ 처리는 8월 23일 화아분화 3단계까지 진행되었고(Fig. 3) 이 시기에 정식을 하면 개화와 첫 수확은 더욱 빠를 것으로 판단된다. 일계성 딸기 품종은 지속적으로 화아분화와 개화가 일어나지 않고, 사계성 품종에 비해 화아분화를 유도하는데 있어서 일장(광주기)과 온도의 감응 범위가 좁다(Bradford et al., 2010). 딸기 육묘기 14℃∼24℃ 저온 처리는 1개월 이상 개화 촉진 효과가 있고, 후속 화방의 발달까지 영향을 주게 되는데(Kumakura and Shishido, 1995), 본 연구에서도 17℃와 20℃ 처리는 자연 조건의 대조구에 비해 13∼16일 일찍 개화하였고, 1화방 수확시기도 18일 이상 빨라서 유사한 결과를 얻을 수 있었다. 저온 처리 기간이 충분하지 못하면 1화방은 자연 상태의 묘와 거의 같은 시기에 출뢰를 하게 되는데, 이는 정식 후에 식물체가 영양생장을 지속하면서 자연조건의 식물체와 같은 속도로 개화를 하기 때문이다(Morishita and Yamakawa, 1991). 온도와 일장 처리에 있어서 처리 일수가 길수록 개화율이 증가하고 개화 촉진에 효과가 있으며(Morishita et al., 1993), 8월 정식 후 40일 동안 딸기 관부 부위에 저온 냉각 처리를 통해 1화방의 개화를 촉진시킬 수 있다(Hidaka et al., 2017). 야간 13℃ 암실과 주간 50% 차광 시설에서 2∼4일 격일로 처리한 묘는 주간에 광합성이 유지되어 식물체 내 탄수화물이 증가하면서 자연조건의 묘보다 개화가 6∼10일 빠르고 균일하였다(Yoshida et al., 2012). 그러나 완전한 암 상태에서는 개화 촉진 효과가 없었다는 보고도 있고(Kumakura and Shishido, 1995), 저온 암흑처리는 화아분화와 개화 속도를 빠르게 유도할 수 있다(Yoshida et al., 2012)는 등의 상반된 결과도 보고되었는데, 이러한 현상은 처리 전의 육묘장 환경, 식물체 내 질소 농도 및 생육상태 그리고 품종 차이에 따른 결과로 생각된다.

Effect of low temperature treatment of strawberry nursery plants on flowering time and harvest periods
저온 처리 별로 식물체 당 과실수를 조사한 결과는 Fig. 5와 같다. 1화방의 11월 과실수는 화아분화와 개화가 빨랐던(Fig. 3, Table 1), 20℃ 처리에서 4.4개로 많았고, 대조구는 1.3개로 가장 적었으며, 12월은 20℃ 처리에서 8.3개, 대조구에서 5.5개 였다. 그러나 1월에는 11월부터 12월까지 과실수가 적었던 25℃ 처리와 대조구에서 6.6개로 많았고, 20℃는 4.8개로 적었다. 2화방의 2월 과실수는 20℃ 처리에서 8.3개로 많았고 대조구는 3.5개로 적었지만, 3월은 25℃, 25/20℃, 대조구에서 10.3∼9.6개로 많았다. 화아분화 이후 꽃 피기 전까지 개화의 과정은 여러 요인에 의해 영향을 받지만, 식물체 영양 상태와 재배 환경은 과실수와 수확량 증가로 이어지는 중요한 단계이다(Strik, 1985). 식물이 생산할 수 있는 최대 과실수는 꽃이 형성될 때 최대로 결실할 수 있는 잠재적 능력과 꽃이 과실로 결실되지 못하는 불결실을 최소화하는 것이라고 하였는데(Webb and White, 1971), 20℃ 처리구는 화아분화 유도 이후에도 화기 발육과 생육에 가장 적합한 온도 조건이 유지되어 과실수가 많고 조기 수확도 가능하였다.
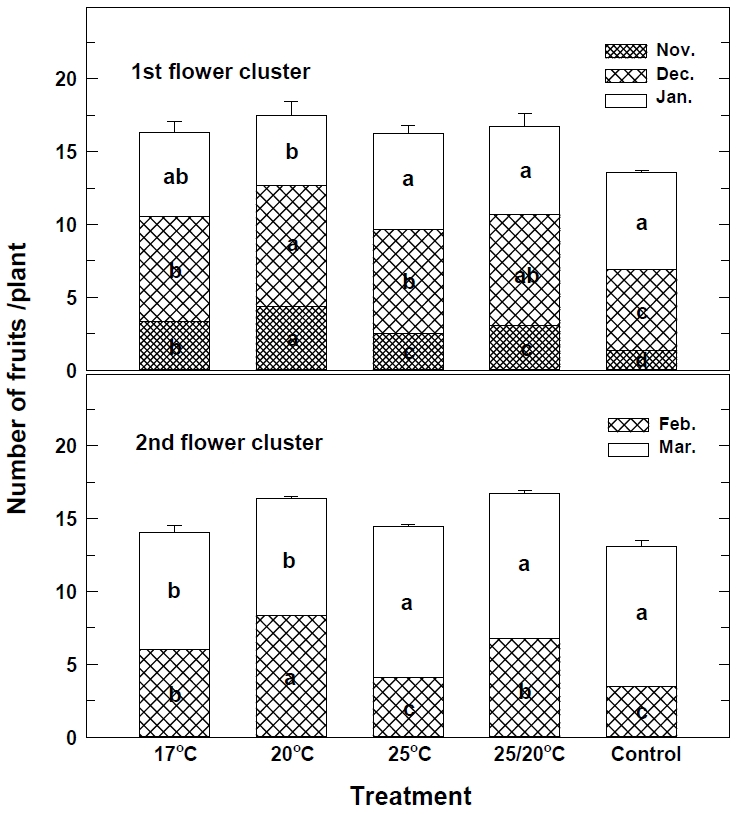
Effect of low temperature treatment of strawberry nuresry plants on number fruit of 1st flower cluster and 2nd flower cluster. Different letters at the same patten indicate a statistical difference according to the Duncan’s multiple rang test at P ≤ 0.05. Vertical bars represent the SE (n=20).
1화방의 과중은 대조구에서 11월과 12월 각각 37.1 g, 27.5 g으로 과실의 크기와 무게가 증가하였다(Fig. 6). 그러나 수확이 빠르고 과실수가 많았던 20℃ 처리의 11월과 12월 과중은 각각 23.1 g, 13.9 g으로 작았다. 1화방의 평균 과중은 대조구에서 26.5 g, 25℃와 20℃ 처리구에서 각각 20.5 g, 15.9 g으로 과실수가 적고 수확 기간이 늦을수록 과실 중량은 증가하였다. 2화방 2월의 과중은 1화방에서 과중이 작았던 20℃ 처리에서 26.8 g으로 크고, 대조구에서 22.7 g으로 작았다. 그러나 3월은 대조구에서 11.5 g으로 크고, 25/20℃ 처리구에서 9.7 g으로 작았다. 과일 크기와 무게는 개화부터 수확기까지의 기간과 밀접한 관련이 있는데, 개화부터 수확기까지의 기간이 길수록 광합성 작용과 과실 생장에 필요한 만큼의 충분한 시간이 제공되어 과실 크기가 증가한다(Kumakura and Shishido, 1995). 개화 후 수확까지의 일수는 낮 온도의 영향이 밤 온도의 영향보다 더 큰 것으로 보이며 평균 온도가 낮을수록 과실은 크고, 동일한 평균 온도에서도 낮과 밤의 온도 차이가 적을수록 과실은 더욱 커진다(Went, 1957; Saito and Ito, 1970; Kumakura and Shishido, 1995). 저온 처리에 의해 화아분화와 개화가 빨랐던 20℃ 처리구는 11월 11일부터 조기 수확하였다. 이 시기 딸기재배 온실은 주간 온도의 상승으로 적산온도가 높아 짧은 기간 내에 과실이 착색되고 성숙이 진행되어 과실의 크기가 작았다. 그러나 12월부터 과실을 수확하는 대조구는 주간 온도가 낮고 성숙 기간이 길어 과실 중량이 증가하였다.
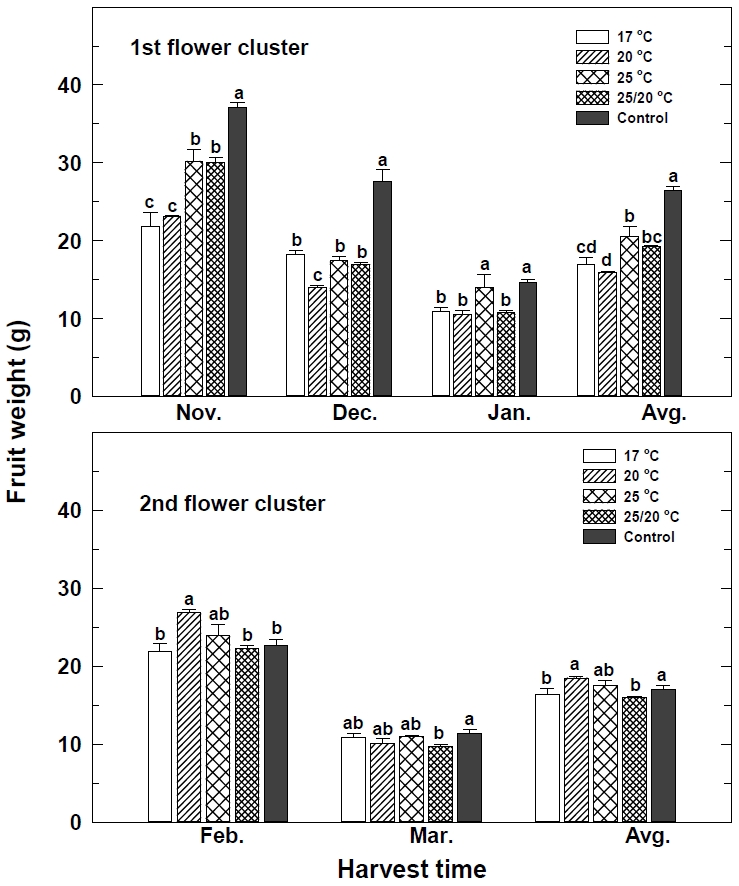
Effect of low temperature treatment of strawberry nuresry plants on fruit weight of 1st flower cluster and 2nd flower cluster. Different letters at the same month indicate a statistical difference according to the Duncan’s multiple rang test at P ≤ 0.05. Vertical bars represent the SE (n=20).
1화방의 11월 과실 수량은 20℃ 처리에서 79.2 g으로 다른 처리에 비해 조기 수량이 현저히 많고, 대조구에서 12.2 g으로 적었다. 12월 수확기에는 처리 별로 104.0 g∼115.1 g으로 유의적인 차이가 없지만, 1월은 11월과 12월에 수량이 적은 대조구에서 85.3 g으로 많았다. 2화방의 수량은 20℃ 처리에서 244.4 g으로 가장 많으며, 대조구에서 168.6 g으로 적었다. 1화방과 2화방의 전체 과실 수량은 20℃ 처리에서 462.9 g, 대조구에서 381.3 g 이었다(Fig. 7). 딸기 육묘기 15℃의 저온 처리는 11월에 상품성 높은 과실을 생산하고, 12월까지 단위 면적당 수확량은 표준 재배에 비해 크게 증가하였으나, 10℃의 낮은 온도는 단위 면적당 수확량이 감소하였다(Kumakura and Shishido, 1995). 10∼15°C의 지속적인 저온 냉각 처리는 식물체 휴면을 유발하거나(Fujime and Yamasaki, 1988), 새잎 발생이 늦고 개화와 과실 생산에 부정적인 영향을 미치는데(Hidaka et al., 2017), 본 연구에서도 11월의 과실 수량은 17℃ 처리에서 49.4 g, 20℃ 처리에서 79.2 g으로, 17℃의 낮은 온도에서 수량이 감소하였다. 그러나 저온 처리 개시가 늦어지면 과실 생장이 느리고 가을에 충분한 양의 과실을 생산할 수 없는데(Thompson, 1961; Chia and Hew, 1987), 저온 처리를 통해 화아분화가 완료된 이후에는 20℃∼25℃의 딸기 생육적온을 유지해야 안정적으로 수량을 증가시킬 수 있었다. Choi et al.(2023)은 7월 4일에 야냉 처리한 묘를 8월 11일 고온기에 정식하여도 화아분화와 개화가 촉진되어 조기 수량이 증가하였고, 특히 ‘설향’ 품종은 10월에 식물체 당 68.6 g으로 높은 수량을 보였다.
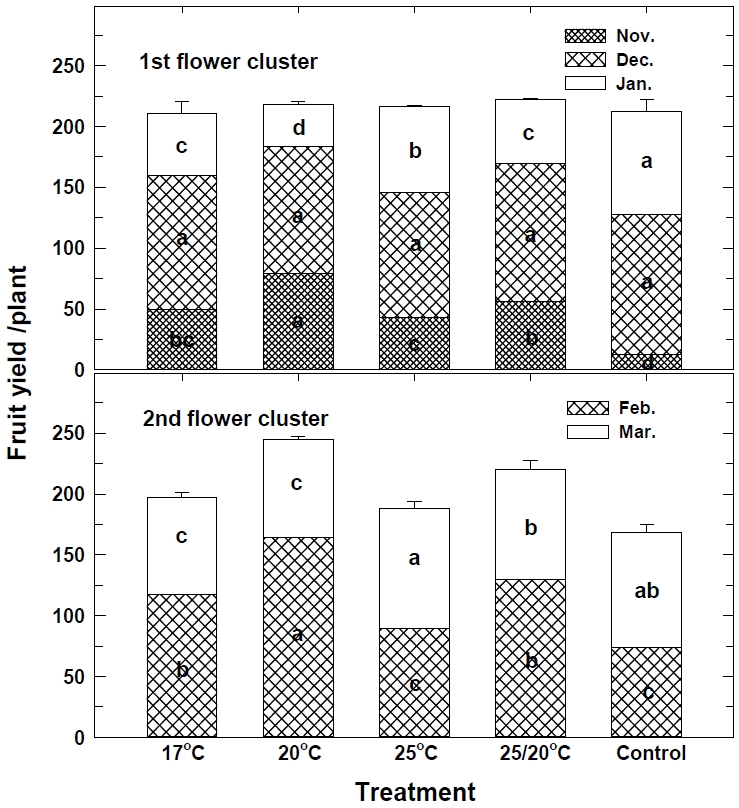
Effect of low temperature treatment of strawberry nuresry plants on fruit yield of 1st flower cluster and 2nd flower cluster. Different letters at the same patten indicate a statistical difference according to the Duncan’s multiple rang test at P ≤ 0.05. Vertical bars represent the SE (n=20).
이와 같은 결과는 본 연구보다 1개월 일찍 저온 처리를 실시하여 수확시기도 1개월 이상 빠른 결과 보였는데, 7∼8월 딸기 육묘기에 저온 처리를 통해서 우리나라에서도 10월부터 조기 수확이 가능할 것으로 판단되었다.
딸기 화아분화는 온도와 일장 그리고 식물체 내 질소 농도 등의 영향을 받아서 생장점이 화아로 발달하고 이후에는 고온과 장일 조건에서 화아의 발육이 촉진된다(Darrow and Waldo, 1937). 화아분화 유도에 있어서 온도가 일장보다 더 중요하게 작용하고, 일장은 보조적으로 작용하는 특징을 지닌다(Kim et al., 1999). 우리나라의 겨울철에 재배되고 있는 딸기 품종은 일계성 품종이고 단일성으로 분류되는데, 가을 또는 9월 말경 묘령이나 묘의 크기와 관계없이 저온과 단일 조건이 되면서 화아분화를 시작하고, 광주기성은 주간 일장보다 야간 일장에 영향을 받는다. 화아분화 유도에 있어서 온도와 일장에 대한 감응도는 육묘 일수가 길거나 큰 묘에서 더 민감하게 반응한다(Ito and Saito, 1962; Darrow, 1966). 우리나라는 늦여름부터 초가을까지의 저온과 단일의 환경조건에서 화아분화를 시작하지만, 환경변화에 따른 이상기후와 기온 상승으로 육묘장의 주·야간 평균 온도가 9월 상순까지 25∼30℃ 유지되어 화아분화를 안정적으로 유도하기 어려운 온도 조건이다(Fig. 1). 본 연구는 우리나라 딸기 재배면적의 85%를 차지하고 있는 ‘설향’ 품종에 대해 육묘 후반기에 저온 처리를 실시하였다. 20℃와 25/20℃ 처리구는 12∼16일 후에 화아분화 3단계까지 진행되어 개화가 10월 15일로 가장 빠르고, 11월부터 12월까지의 조기 수량도 가장 많았다. 그러나 25℃ 처리는 화아분화 시기에 있어서 대조구와 유사하여 ‘설향’ 품종에 대한 화아분화의 감응정도와 한계온도를 확인할 수 있었다.
4. 결 론
딸기 육묘기 저온 처리가 ‘설향’ 딸기의 화아분화 특성, 개화기 및 조기 수량에 미치는 영향을 구명하고자 수행하였다. 6월 10일 딸기 육묘장에서 삽목한 묘는 8월 7일에 온도 17℃, 20℃, 25℃, 20/25℃, 일장 13/11(주간/야간)으로 설정한 식물 생장상에서 9월 9일까지 화아분화를 유도한 후 화아분화 진행단계를 검경하였다. 저온 처리한 묘는 9월 9일 수경재배용 고설 베드에 정식하여 개화기 및 과실 특성을 조사하였다. 화아분화는 저온 처리 12∼16일 후 20℃와 20℃/25℃에서 3단계까지 가장 빠르게 진행되었고, 25℃와 대조구는 처리 후 32일에 2단계 수준으로 현저하게 늦었다. 개화기는 20℃ 처리에서 10월 15일로 대조구 11월 1일보다 16일 빨리 개화하였다. 과실 수확은 17℃와 20℃ 처리에서 11월 11일부터 첫 수확을 하였고, 대조구의 11월 29일보다 18일 빨리 조기 수확하였다. 과실수는 20℃ 처리에서 11월과 12월에 각각 4.4개, 8.3개로 대조구 1.3개, 5.5개 보다 많았지만, 과중은 대조구에서 11월과 12월 각각 37.1 g, 27.5 g으로 크고 무거웠다. 1화방의 과실 수량은 20℃ 처리에서 11월과 12월 각각 79.2 g, 104.0 g으로 가장 많았다. 그러나 대조구는 1월의 수량이 증가하면서 1화방의 수량은 211.0 g∼221.9 g으로 처리 간 유의적인 차이는 없었다. 2화방의 수량은 20℃ 처리에서 244.6 g으로 대조구 168.6 g보다 많았다.
REFERENCES
- Austin, M. E., Shutak, V. G., Christopher, E. P., 1961, Responses of sparkle strawberry to inductive cycles, Proc. Amer. Soc. Hort. Sci., 77, 372-375.
-
Bradford, E., Hancock, J. F., Warner, R. M., 2010, Interactions of temperature and photoperiod determine expression of repeat flowering in strawberry, J. Am. Soc. Hortic. Sci., 135, 102-107.
[https://doi.org/10.21273/JASHS.135.2.102]

-
Chia, T., Hew, C., 1987, Effects of noral excision on reversion from reproductive to vegetative development in strawberry, HortScience, 22, 672-673.
[https://doi.org/10.21273/HORTSCI.22.4.672]

-
Choi, S. H., Kim, D. Y., Kim, S., Gil, C. S., 2023, Effect of short day and low temperature at the nursery stage on the inflorescence and yield of six different strawberry (Fragaria ananassa Duch.) cultivars in a soilless culture system, Agriculture, 14, 22.
[https://doi.org/10.3390/agriculture14010022]

- Darrow, G. M., 1966, The Strawberry: History breeding and physiology, Holt. Rinehart and Winston, New York.
- Darrow, G. M., Waldo, G. F., 1937, Interrelation of temperature and photoperiodism in the production of fruit buds and runners in the strawberry, Proc. Amer. Soc. Hort. Sci., 34, 360- 363.
-
Durner, E. F., Barden, J. A., Himelrick, D. G., Poling, E. B., 1984, Photoperiod and temperature effects on flower and runner development in day-neutral, June-bearing, and everbearing strawberries, J. Amer. Soc. Hort. Sci., 109, 396–400.
[https://doi.org/10.21273/JASHS.109.3.396]

- Eguchi, T., 1932, Flower bud differentiation and development in strawberry, J. Japan. Soc. Hort. Sci., 3, 21–31.
-
Fujime, Y., Yamasaki, N., 1988, Effects of pretreatment, day length and temperature on induction and breaking of dormancy in strawberry plants, J. Jpn. Soc. Hortic. Sci., 56, 444-451.
[https://doi.org/10.2503/jjshs.56.444]

-
Hidaka, K., Dan, K., Imamura, H., Takayama, T., 2017, Crown-cooling treatment induces earlier flower bud differentiation of strawberry under high air temperatures, Environ. Control Biol., 55, 21-27.
[https://doi.org/10.2525/ecb.55.21]

- Hwang, J. G., 2010, A Study on the off-season production by low temperature treatment of strawberries for new domestic breeding varieties, Ph. D., Department of Horticulture and Landscape Architecture, Daegu University, Gyeongbuk, Korea.
-
Ikeda, T., Yamazaki, K., Kumakura, H., Hamamoto, H., 2007, Effects of cooling of medium on fruit set in high-bench strawberry culture, HortScience, 42, 88-90.
[https://doi.org/10.21273/HORTSCI.42.1.88]

- Ito, H., Saito. T., 1962, Studies on the flower formation in the strawberry plants, I. Effects of temperature and photoperiod on the flower formation, Tohoku J. Agr. Res., 13, 191-203.
-
Jun, H. J., Liu, S. S., Jeon, E. H., Bae, G. H., Kang, S. I., 2013, Effect of low temperature-darkness treatment on floral initiation and flowering response of Korean strawberry cultivars, Korean J. Horti. Sci. Technol., 31, 726-731.
[https://doi.org/10.7235/hort.2013.13058]

- Kim, W. S., Kim, T. I., Choi, J. H., Seo, K. S., Won, S. H., Yoon, W. M., 1999, Flower bud differentiation and growth characteristics of strawberry through automatic control of temperature and day length, Korean J. Horti. Sci. Technol., 17, 325-328.
- Kumakura, H., Shishido, Y., 1995, Effects of temperature and light conditions on flower initiation and fruit development in strawberry, JARQ, 29, 241-250.
-
Miyoshi, Y., Hidaka, K., Okayasu, T., Hirano, O., Yasutake, D., Kitano, M., 2013, Application of the constant soil temperature layer for energy-saving control of the local environment of greenhouse crops. I. Local control of the ambient environment of strawberry, Environ. Control Biol., 51, 89-94.
[https://doi.org/10.2525/ecb.51.89]

-
Morishita, M., Yamakawa, O., 1991, Varietal differences in the sensitivity to short-day and low temperature treatment by June-bearing strawberry cultivars, J. Jpn. Soc. Hort. Sci., 60, 539-546.
[https://doi.org/10.2503/jjshs.60.539]

-
Morishita, M., Mochizuki, T., Yamakawa, O., 1993, Flower induction and selection on earliness of strawberry seedlings by short-day and low night temperature treatment, J. Jpn. Soc. Hort. Sci., 61, 857-864.
[https://doi.org/10.2503/jjshs.61.857]

-
Mukai, T., Ogura, Y., 1988, Development of a technique for promoting flower-bud differentiation of strawberry plants by using night cooling NFT system, Environ. Control Biol., 26, 1-7.
[https://doi.org/10.2525/ecb1963.26.1]

- Saito, T., Ito, H., 1970, Studies on the fruit development in the strawberry plants, I. The process of fruit development and relationship between flower and fruit development, In Abst. Jpn. Hort. Sci., 176-177.
-
Smeets, L., 1980, Effect of temperature and daylength on flower initiation and runner formation in two everbearing strawberry cultivars, Sci. Hortic., 12, 19-26.
[https://doi.org/10.1016/0304-4238(80)90034-5]

- Strik, B. C., 1985, Flower bud initiation in strawberry cultivars, Fruit Var. J., 39, 5-9.
-
Thompson, P. A., 1961, Evidence for a factor which prevents the development of parthenocarpic fruits in the strawberry, J. Exp. Bot., 12, 199-206.
[https://doi.org/10.1093/jxb/12.2.199]

-
Webb, R. A., White, B. A., 1971, The effect of rooting date on flower production in the strawberry, J. Hortic. Sci., 46, 413-423.
[https://doi.org/10.1080/00221589.1971.11514420]

- Went, F. W., 1957, The experimental control of plant growth. Chrooica Botanica Co., Waltham, Mass., U.S.A., 129–138.
-
Yoshida, Y., Ozaki, E., Murakami, K., Goto, T., 2012, Flower induction in June-bearing strawberry by intermittent low temperature storage, J. Jpn. Soc. Hort. Sci., 81, 343-349.
[https://doi.org/10.2503/jjshs1.81.343]

-
Zhang, X., Himelrick, D. G., Woods, F. M., Ebel, R. C., 2001, Effect of temperature, photoperiod and pretreatment growing condition on floral induction in spring bearing strawberry, Small Fruits Review, 1, 113-123.
[https://doi.org/10.1300/J301v01n02_11]

Division of Smart Return to Farm and Rural Affairs, University of Gyeongnam Geochangkaki-fuyu@hanmail.net
Division of Smart Agriculture Smart Agriculture Promotion Team, Korea Agriculture Technology Pormotion Agencysmarberry1@koat.or.kr
Division of Horticultural Science, Gyeongsang National Universitytg306801@naver.com
Division of Horticultural Science, Gyeongsang National Universitydmscks4665@nvaer.com
Division of Horticultural Science, Gyeongsang National Universitystraw3259@gnu.ac.kr