배나무 화상병 심각도 평가 기반 엽록소 형광 이미지 해석
1)한경국립대학교 식물자원조경학과2)한경국립대학교 식물생태화학연구소
3)경기도농업기술원 환경농업연구과
2)Institute of Ecological Phytochemistry, Hankyong National University, Anseong 17579, Korea
3)Department of Environmental and Agricultural Research, Gyeonggi-do Agricultural Research and Extension Services, Hwaseong 18388, Korea
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study utilized RGB images to quantify the lesion area of fire blight-infected pear leaf disks and analyzed chlorophyll fluorescence responses according to disease severity. Chlorophyll fluorescence imaging distinguished healthy and infected areas, revealing the spread of symptoms along the leaf veins. The invasion of Erwinia amylovora resulted in chlorophyll degradation, leading to a decrease in fluorescence intensity. Analysis of chlorophyll fluorescence parameters showed that as disease severity (DS) increased, certain parameters increased, while others e.g., Fm, Fv, QY_max, Fv/Fm_Lss, decreased. These changes indicate that chloroplast damage reduces the capacity for light energy capture and its conversion into photochemical energy, impairing photosynthetic efficiency. However, healthy areas activated photoprotection mechanisms as a defense strategy to maintain the efficiency of Photosystem II before tissue necrosis occurred. This study highlights the potential of using chlorophyll fluorescence parameters to assess disease severity and provides a foundational resource for studying the photosynthetic mechanisms between pathogenic microorganisms and plant tissues.
Keywords:
Disease severity, Pear tree, Fire blight, RGB, Chlorophyll fluorescence image1. 서 론
과수 화상병은 Erwinia amylovora 병원균에 의해 사과, 배 등 장미과 과수나무에서 발생하는 전염력이 높은 세균병으로, 4~37℃의 넓은 범위에서도 성장하며 비, 바람, 곤충, 사람 등 다양한 요인에 의해 전파된다 (Zwet and Orolaza-Halbrendt, 2012; EPPO, 2013; Park et al, 2017). 화상병은 꽃, 열매, 가지, 잎 등의 조직이 흑갈색으로 타들어가는 증상을 보이며(Billing, 2011), 국내에서는 2015년 안성의 배나무 과원과 제천의 사과 과원에서 처음으로 보고되었다(Myung et al, 2016; Ham et al, 2020; Park et al, 2023). 이후 화상병의 감염속도가 급격히 증가하여 최근 5년(2019~2023년)간 화상병 발생 상황은 총 2,029건으로 농가 및 국가의 큰 경제적 피해를 초래하여 국내에서는 금지 병원균으로 지정 및 관리되고 있다(Ham et al., 2020; Ham et al., 2024).
한편, 식물병 심각도(Plant severity)는 식물병의 증상 수준을 정량적으로 측정하는 매개변수로, 정확한 판정은 식물병 모니터링, 수확량 손실, 질병 예측 등 식물 병리학 연구의 기초가 된다(Wang et al., 2017). 그러나 식물병 심각도는 주로 전문가의 육안 평가에 의존하므로 정확도와 정밀도에 큰 영향을 받는 단점이 있다(Bock et al., 2010). 이에 따라 최근 센서 기반의 표현체 분석을 통한 식물병의 심각도를 평가하는 기술 연구가 개발되고 있다(Oerke et al., 2010; Sankaran et al., 2010; Mahlein., 2016). 그 중 RGB 센서를 활용한 디지털 이미지 분석은 Red, Green, Blue 각각의 스펙트럼 지수 및 픽셀 값을 이용하여 식물병의 면적을 정량적으로 평가 할 수 있다(Osuna-Caballero et al., 2023). 이는 전문가의 시각적 평가보다 높은 정확도, 재현성, 신속성을 제공하며, 대규모 데이터를 비파괴적으로 분석 할 수 있다는 장점이 있다 (Mutka and Bart, 2015). 또한, 비파괴 센서 분석기술 중 하나인 엽록소 형광 이미지(Chlorophyll fluorescence image, CFI)분석은 식물체 잎에있는 엽록소 a의 형광 방출량을 통해 광합성 반응 과정 및 에너지 변화를 비파괴적으로 평가하여 생물적 또는 비생물적 스트레스에 의해 유발되는 생리적 변화를 확인할 수 있다(Pérez-Bueno et al., 2019; Lee et al., 2020). 병원균의 침입은 잎 조직의 색상, 증산 속도, 광합성 능력의 변화를 유발하기 때문에, 엽록소 형광 기술은 밀 녹병, 사탕무 곰팡이병, 담배 모자이크병 등 다양한 생물학적 스트레스 진단 및 평가에 활용되고 있다(Chaerle et al., 2004; Burling et al., 2011; Konanz et al., 2014). 그러나 과수 화상병이 국내에 보고된 후 화상병 발병에 따른 배나무 잎의 생리학적 변화에 대한 연구는 미비한 상황이다. 따라서 본 연구는 RGB 이미지를 활용하여 화상병 심각도(DS)를 설정하고 DS 수준에 따른 엽록소 형광 반응을 확인하여 잎의 생리적 변화를 확인하였다.
2. 재료 및 방법
2.1. 시료수집 및 균주 배양
본 연구의 시료는 한경국립대학교 부속농장 내 배나무 화상병 격리시설에서 재배한 건전한 배나무(신고 20년생)의 전개된 신초의 잎을 대상으로 수집하였다. 채취한 잎은 직경 2.5 cm의 홀 펀치를 활용하여 동일한 크기의 Leaf disk로 제작하였다. 농촌진흥청에서 허가받아 취득한 E. amylovora 균주는 TSA(Tryptic soy agar) 배지에서 48시간 동안 30℃에서 배양하였다.
2.2. 화상병원균 인공 접종
배양한 E. amylovora는 1x108 CFU (Colony forming unit)mL-1 농도로 멸균수에 현탁하였으며, 제조한 세균 현탁액에 5분동안 Leaf disk를 담구어 인공 접종을 실시하였다. 접종이 끝난 Leaf disk는 습도 유지를 위해 멸균수를 적신 티슈가 깔린 Sqaure dish에 담아 병원균의 최적 활성 온도 조건에 따라 25℃로 설정한 식물 생장상 챔버(HB-303D, HANBAEK)에서 일정한 광조건(12 h/12 h)으로 보관하였다.
2.3. 병징면적 조사 및 식물병 심각도 설정
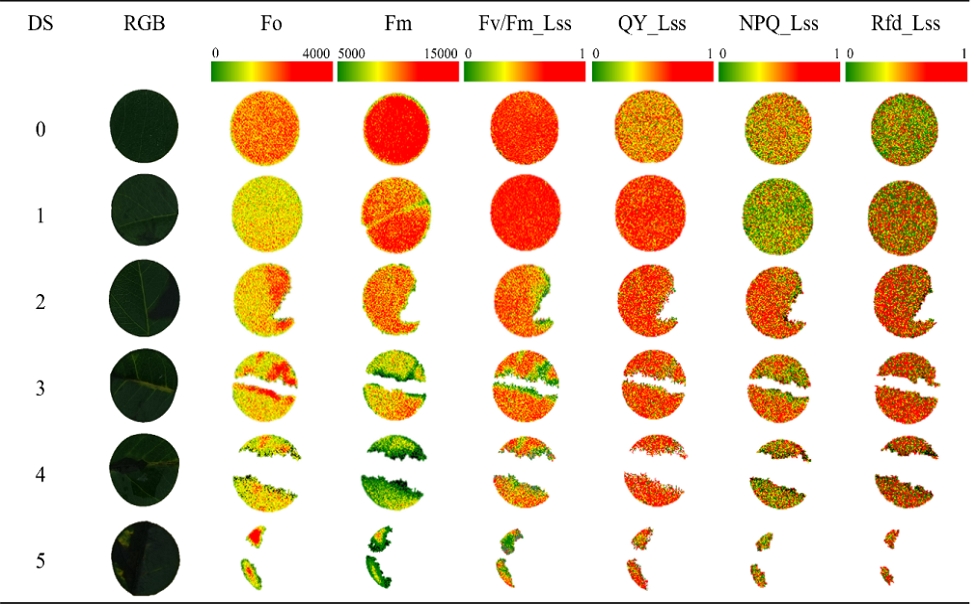
화상병 감염 Leaf disk의 병반면적을 산출하기 위해 접종 10일 후 디지털 카메라(ILCE-7, SONY)를 활용해 40 cm의 높이조건에서 동일하게 촬영하였다. 병징면적은 R(v 4.3.2; R Core Team, 2021)의 ‘FIELDimage R’ package를 활용하여 Leaf disk 면적 대비 검게 발병한 면적을 산출하였다. 잎의 병반면적에 따라 화상병 심각도(Disease severity, DS)는 6수준(DS 0 ~ DS 5) 으로 나누어 건전한 Leaf disk는 DS 0으로 설정하였으며, 1~10% 병반면적을 나타낸 Leaf disk는 DS 1, 11~20% 병반면적의 Leaf disk는 DS 2, 21~30% 병반면적의 Leaf disk는 DS 3, 31~50% 병반면적의 Leaf disk는 DS 4 그리고 51% 이상의 병반면적을 나타낸 Leaf disk는 DS 5으로 설정하였다(Fig. 1).
2.4. 엽록소 형광 이미지 측정
엽록소 형광 반응은 엽록소 형광 이미지 측정기(Closed FluorCam, PSI, Czech Republic)를 사용하여 30분간 암처리 이후 Quenching kinetics analysis 방법(Genty et al., 1989; Barbagallo et al., 2003)으로 측정을 하였다. FluorCam의 분석 조건은 화학광선(Actinic light)을 200 μmol m-2s-1, 연속광원(Saturating light)을 1,250 μmol m-2s-1으로 설정하였다. 측정된 데이터는 JIP-test를 실시하여 (Gorbe and Calatayud, 2012) 화상병 심각도에 따른 건전성 분석을 진행하였다.
2.5. 통계분석
통계분석은 R(v 4.3.2; R Core Team, 2021)을 이용하여 화상병 심각도에 따른 엽록소 형광 매개변수의 상관성을 확인하기 위해 화상병 심각도(DS)와 엽록소 형광 매개변수 간의 Pearson 상관분석을 실시하였다. 또한, 화상병 심각도 수준에 따른 엽록소 형광 매개변수 변화를 확인하기 위해 분산분석(ANOVA) 후, Duncan의 다중 범위검정(Duncan’s multiple range test)을 95% 신뢰수준에서 실시하여 유의성을 확인하였다.
3. 결과 및 고찰
3.1. 화상병 심각도에 따른 엽록소 형광 이미지
엽록소 형광 이미지(Chlorophyll fluorescence image, CFI)는 식물체의 잎에서 공간적으로 형광량의 차이를 확인할 수 있다. 따라서 화상병 심각도에 따른Leaf disk의 공간적 엽록소 형광반응을 이미지로 확인하였으며, 각 매개변수의 형광 강도에 의한 색의 변화(초록색 : 형광 강도 낮음, 붉은색 : 형광 강도 강함)를 근거로 분석하였다. 본 시험을 통해 엽록소 형광 이미지를 통해 건전부분과 병반면적을 구분함으로써 잎의 주맥을 따라 병징이 발현되는 것을 확인할 수 있었으며, 이는 화상병원균이 잎의 주맥을 따라 이동한다는 선행연구 결과와 일치하였다(Billing et al., 2011). 또한 화상병 심각도(DS)가 증가함에 따라 암적응 최대형광량(Fm)과 연속광에서의 광계 II 최대양자수득률(Fv/Fm_Lss)이 감소하는 것을 색의 변화를 통해 확인하였다. 따라서 본 연구를 통해 화상병 감염 시 발병부위 및 병 심각도에 따른 엽록소 형광량의 공간적 변화를 확인할 수 있었다.

Summary of the chlorophyll fluorescence (ChlF) parameters (Modified from Gorbe and Calatayud’s data, 2012)
3.2. 화상병 심각도에 따른 엽록소 형광 매개변수
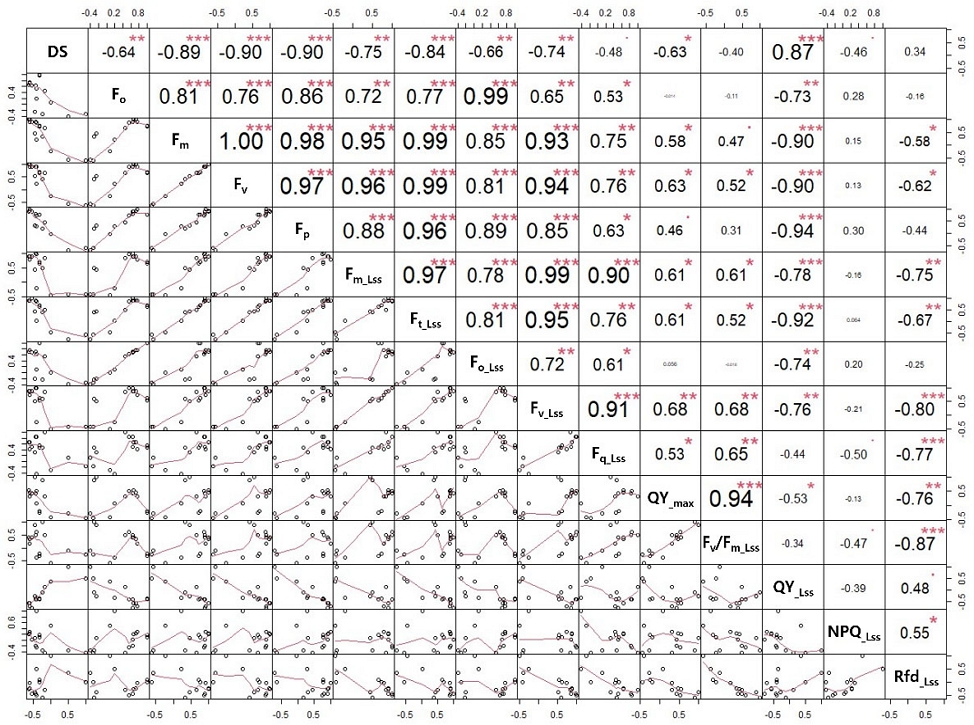
화상병 심각도(DS)와 엽록소 형광 매개변수의 상관성을 확인하기 위해 Pearson 상관분석을 실시하여 DS와 높은 상관계수(r =±0.7 ~±1.0)를 나타내는 엽록소 형광 매개변수를 확인하였다 (Ratner, 2009). 상관분석 결과, 엽록소 형광 매개변수 중 Fm, Fv, Fp, Fm_Lss, Ft_Lss, Fv_Lss가 부(-)의 상관관계를 가지는것으로 나타나며 DS가 증가함에 따라 Fm, Fv, Fp, Fm_Lss, Ft_Lss, Fv_Lss 등의 매개변수는 감소하는 경향을 나타냈다(Fig. 3). 반면, QY_Lss는 정(+)의 상관관계를 나타내며 DS가 증가함에 QY_Lss 매개변수는 증가하는 경향을 나타냈다.
엽록소 형광 매개변수 분석 결과, 화상병 심각도(DS)에 따라 암적응 형광값(Fm, Fv, Fp)과 명적응 정류상태 형광값(Fm_Lss, Ft_Lss, Fq_Lss, Fv_Lss, NPQ_Lss)이 유의적으로 감소하였다. DS가 증가함에 따라 암적응 최대형광량(Fm)과 가변형광량(Fv = Fm - Fo)이 감소하는 것으로 확인되었다(Fig. 4B, 4C). 형광량의 감소는 병반의 확장으로 잎의 엽록소가 파괴되어 광계(PSII)가 빛에너지를 포획하고 광화학에너지로 변환하는 능력이 감소하여 전자의 이동이 감소하는 것으로 판단되었다. 이는 식물이 병원균에 감염되면 엽록소 함량이 감소함에 따라 광에너지를 흡수할 수 있는 반응중심이 감소하여 광합성기구의 활성저해 및 광에너지 손실이 발생하는 것으로 알려져있는 연구결과(Ham et al, 2018; Liu et al, 2023)와 일치하였다. 또한 정류상태 광화학적 소광(NPQ_Lss)의 감소를 통해 PSII와 PSI의 활성 감소 및 광합성 전자전달 억제가 이루어지는 것으로 확인되었다(Yoo et al., 2015).
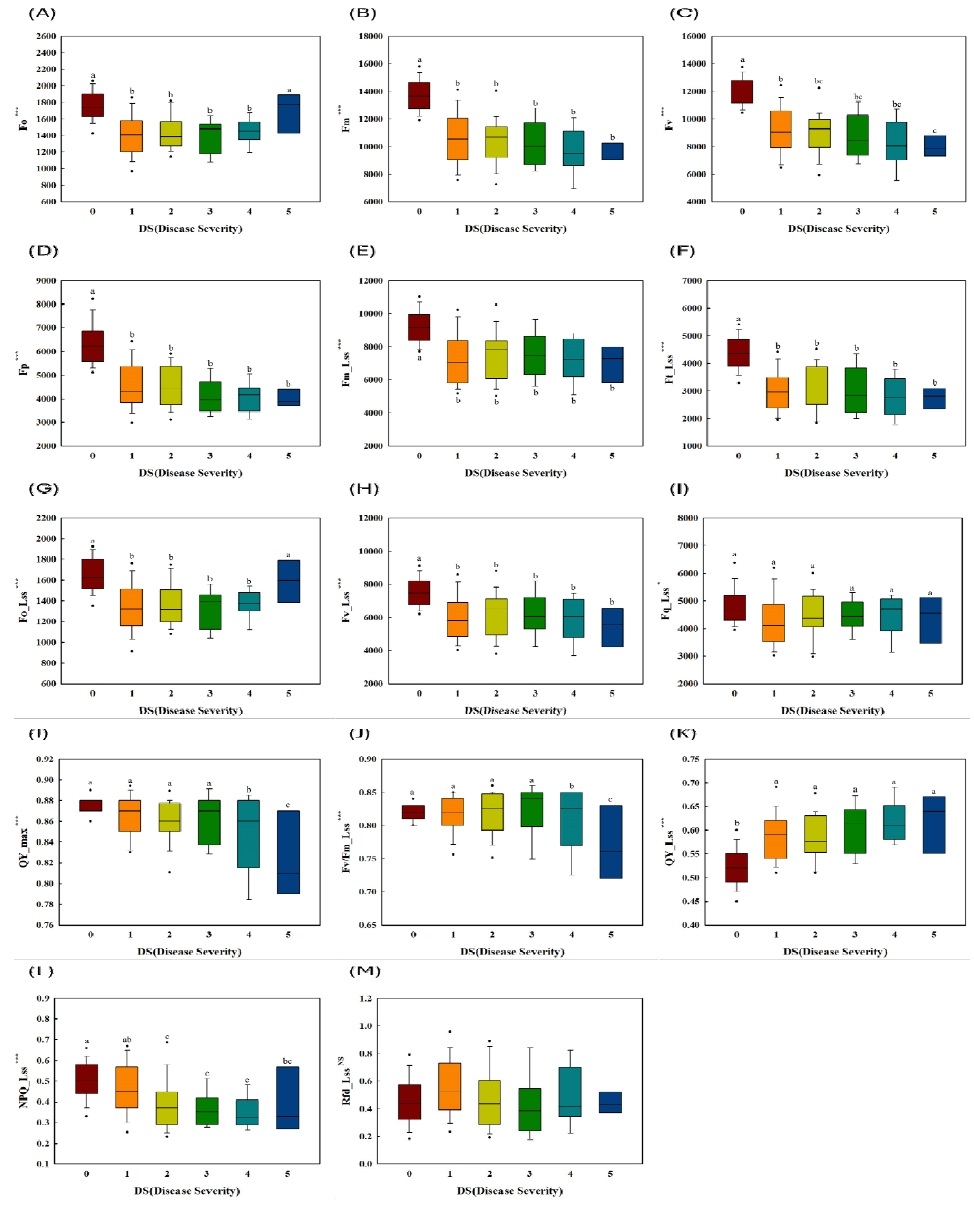
Comparison of chlorophyll fluorescence parameters between disease severity (DS) levels using boxplots. The horizontal lines in the boxplots represent medians, boxes represent the quartiles, and the whiskers represent the minimum and maximum values. Circles indicate outliers, and asterisks indicate statistically significant differences ( * : p < .05, ** : p < .01, *** : p < .001).
엽록소 형광 매개변수 중 대부분의 매개변수는 감소하였으나 암적응 및 연속광 상태에서의 최소형광량(Fo, Fo_Lss)은 화상병 심각도가 가장 높은 수준인 DS 5에서 증가하였다(Fig. 4A, 4G). 최소형광량의 증가는 화상병이 심해질수록 감염된 잎의 엽록소가 분해되면서 적색 파장 빛의 흡수가 감소하는 것으로 판단되었으며 밀의 녹병과 목화의 버티실리움 위조병과 같은 경향을 보였다(Gitelson et al., 1998; Shen and Li, 2011; Xiao et al., 2022). PSII의 유효 양자효율을 평가할 수 있는 QY_Lss매개변수는 화상병 발병 면적에 따른 증가보다는 병원균 유무에 따라DS 0 대비 DS 1~5에서 증가하며(Fig. 4K), Shen의 PWN (Bursapherenchus xylophilus)감염 시 증가한 연구결과와 동일하였다 (Shen et al., 2023). 이는 식물의 과민반응 중 세포사멸을 통한 병원균 확산 방어기작으로 미토콘드리아 및 엽록체가 일부 손상되었지만 남아있는 건전한 면적은 광보호 기작을 활성화 하여 고사하기 전까지 광계II의 효율을 유지하려고 하는것으로 사료되었다(Mur et al., 2008). 한편, 형광감소량을 의미하는 Rfd_Lss매개변수는 DS에 따른 차이가 없는 것으로 확인되었다(Fig. 4M). 형광감소량은 광화학 기구의 소광 및 전자전달 속도 등과 관련된 매개변수로, 본 연구에서는 병원균 감염으로 광화학적 반응이 손상되었지만 광합성계 보호 메커니즘이 활성화 되어 유의미한 차이가 나타나지 않은 것으로 판단되었다(Lichtenthaler and Rinderle, 1988; Yoo et al., 2012).
따라서 화상병 심각도 수준에 따라 증가 및 감소하는 엽록소 형광 매개변수를 확인하여 배나무 화상병 감염수준에 따른 광합성 능력을 평가할 수 있었으며, 추후 엽록소 형광 이미지 기술을 활용한 과수 화상병 진단 및 평가가 가능할 것으로 확인된다.
4. 결 론
본 연구는 RGB 이미지를 활용하여 화상병 감염 Leaf disk의 병반면적을 산출하고 화상병 심각도에 따른 엽록소 형광 반응을 확인하였다. 엽록소 형광 이미지를 통해 잎에서 공간적으로 병반을 구분할 수 있어(Chaerle et al., 2007; Sekulska-Nalewajko et al., 2019), 병반을 따라 형광량이 감소하여 주맥과 잎맥을 따라 화상병이 진행되는 것을 확인하였다. 또한 엽록소 형광 매개변수를 활용하여 화상병 심각도가 증가함에 따라 엽록소 함량 감소와 광계(PSII, PSI)의 손상으로 인해 광에너지를 흡수하는 반응중심 감소와 전자전달 억제가 이루어지는 것을 다양한 매개변수의 감소로 확인할 수 있었다(Yoo et al., 2015; Ham et al., 2018; Liu et al., 2023). 반면 Fo, Fo_Lss, QY_Lss 등의 매개변수 증가는 감염된 Leaf disk의 엽록체가 분해되어 적색 파장 범위의 빛의 흡수가 감소하였으나 남아있는 건전한 면적은 고사하기 전까지 광계 II의 효율을 유지하기 위한 과민반응으로 판단되었다. 따라서, 병반이 확장되며 줄어든 건전한 면적은 PSII의 효율 유지를 위해 광보호 기작을 활성화 하였지만 과도한 광에너지를 효과적으로 소산시키지 못하며 고사할 것으로 사료되었다(Gitelson et al., 1998; Xiao et al., 2022).
결론적으로, 본 연구는 이미지 센서와 엽록소 형광 반응 센서를 활용하여 화상병 심각도 수준에 따른 배나무 잎의 광합성 능력을 평가하며, 배나무 잎에 E. amylovora 병원균이 침입했을 때와 병 심각도에 따른 광생리적 변화를 간접적으로 평가할 수 있었다. 그러나 병의 심각도 수준 평가는 심각도가 높을수록 오류 및 편차가 발생할 수 있어(Bock et al, 2010; Chiang, 2022), 보다 구체적이고 세밀한 척도를 기준으로 비교하고 평가하는 연구가 필요할 것으로 생각된다. 또한, 화상병 진단 여부를 평가할 수 있는 엽록소 형광 매개변수를 선발하여 향후 비파괴적으로 병원성 미생물과 식물체 간의 광합성 메커니즘을 연구하는 것이 중요할 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호 : RS-2021-RD012471)의 일부 지원으로 이루어진 것입니다.
REFERENCES
-
Barbagallo, R. P., Oxborough, K., Pallett, K. E., Baker, N. R., 2003, Rapid, noninvasive screening for perturbations of metabolism and plant growth using chlorophyll fluorescence imaging, Plant Physiology, 132(2), 485-493.
[https://doi.org/10.1104/pp.102.018093]

-
Billing, E., 2011, Fire blight. Why do views on host invasion by Erwinia amylovora differ?, Plant Pathology, 60(2), 178-189.
[https://doi.org/10.1111/j.1365-3059.2010.02382.x]

-
Bock, C., Poole, G., Parker, P., Gottwald, T, 2010, Plant disease severity estimated visually, by digital photography and image analysis, and by hyperspectral imaging, Critical reviews in Plant Sciences, 29(2), 59-107.
[https://doi.org/10.1080/07352681003617285]

-
Bürling, K., Hunsche, M., Noga, G., 2011, Use of blue–green and chlorophyll fluorescence measurements for differentiation between nitrogen deficiency and pathogen infection in winter wheat, Journal of Plant Physiology, 168(14), 1641-1648.
[https://doi.org/10.1016/j.jplph.2011.03.016]

-
Chaerle, L., Hagenbeek, D., De Bruyne, E., Valcke, R., Van Der Straeten, D., 2004, Thermal and chlorophyll-fluorescence imaging distinguish plant-pathogen interactions at an early stage, Plant and Cell Physiology, 45(7), 887-896.
[https://doi.org/10.1093/pcp/pch097]

-
Chaerle, L., Hagenbeek, D., De Bruyne, E., Van Der Straeten, D, 2007, Chlorophyll fluorescence imaging for disease-resistance screening of sugar beet, Plant Cell, Tissue and Organ Culture, 91, 97-106.
[https://doi.org/10.1007/s11240-007-9282-8]

-
Chiang, K. S., Bock, C. H., 2022, Understanding the ramifications of quantitative ordinal scales on accuracy of estimates of disease severity and data analysis in plant pathology, Tropical Plant Pathology, 47(1), 58-73.
[https://doi.org/10.1007/s40858-021-00446-0]

-
EPPO, 2013, PM 7/20 (2)* Erwinia amylovora, EPPO Bulletin, 43, 21-45.
[https://doi.org/10.1111/epp.12019]

-
Genty, B., Briantais, J. M., Baker, N. R., 1989, The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence, Biochimica et Biophysica Acta (BBA)-General Subjects, 990(1), 87-92.
[https://doi.org/10.1016/S0304-4165(89)80016-9]

-
Gitelson, A. A., Buschmann, C., Lichtenthaler, H. K., 1998, Leaf chlorophyll fluorescence corrected for re-absorption by means of absorption and reflectance measurements, Journal of Plant Physiology, 152(2-3), 283-296.
[https://doi.org/10.1016/S0176-1617(98)80143-0]

-
Gorbe, E., Calatayud, A., 2012, Applications of chlorophyll fluorescence imaging technique in horticultural research: A Review, Scientia Horticulturae, 138, 24-35.
[https://doi.org/10.1016/j.scienta.2012.02.002]

-
Ham, H. D., Kim, T. S., Lee, M. H., Park, K. B., An, J. H., Kang, D. H., Kim, T. W., 2018, The assessment of photochemical index of nursery seedlings of cucumber and tomato under drought stress, Korean Journal of Environmental Biology, 36(4), 479-487.
[https://doi.org/10.11626/KJEB.2018.36.4.479]

-
Ham, H. H., Lee,Y. K., Kong, H. G., Lee, K. J., Oh, G. R., Lee, M. H., Lee, Y. H., 2020, Outbreak of fire blight of apple and Asian Pear in 2015-2019 in Korea, Research in Plant Disease, 26, 222-228.
[https://doi.org/10.5423/RPD.2020.26.4.222]

-
Ham, H. H., Roh, E. J., Lee, M. H., Lee, Y. K., Park, D. S., Kim, K., Lee, B. W., Lee, W., Choi, H. W., Lee, Y. H., 2024, Emergence characteristics of fire blight from 2019 to 2023 in Korea, Research in Plant Disease, 30(2), 139-147.
[https://doi.org/10.5423/RPD.2024.30.2.139]

-
Konanz, S., Kocsányi, L., Buschmann, C., 2014, Advanced multi-color fluorescence imaging system for detection of biotic and abiotic stresses in leaves, Agriculture, 4(2), 79-95.
[https://doi.org/10.3390/agriculture4020079]

-
Lee, M. K., Yoo, S. Y., Kim, T. W., Ku, H, H., 2020, Application of chlorophyll fluorescence imaging technique to estimate fresh weight in kiwifruit, Korean Journal of Environmental Agriculture, 39(2), 138-141.
[https://doi.org/10.5338/KJEA.2020.39.2.18]

-
Lichtenthaler, H. K., Rinderle, U., 1988, The role of chlorophyll fluorescence in the detection of stress conditions in plants, CRC Critical Reviews in Analytical Chemistry, 19(sup1), S29-S85.
[https://doi.org/10.1080/15476510.1988.10401466]

-
Liu, Y., Zhang, Y., Jiang, D., Zhang, Z., Chang, Q., 2023, Quantitative assessment of apple mosaic disease severity based on hyperspectral images and chlorophyll content, Remote Sensing, 15(8), 2202.
[https://doi.org/10.3390/rs15082202]

-
Mahlein, A. K., 2016, Plant disease detection by imaging sensors–parallels and specific demands for precision agriculture and plant phenotyping, Plant Disease, 100(2), 241-251.
[https://doi.org/10.1094/PDIS-03-15-0340-FE]

-
Mur, L. A., Kenton, P., Lloyd, A. J., Ougham, H., Prats, E., 2008, The hypersensitive response; The centenary is upon us but how much do we know?, Journal of Experimental Botany, 59(3), 501-520.
[https://doi.org/10.1093/jxb/erm239]

-
Mutka, A. M., Bart, R. S., 2015, Image-based phenotyping of plant disease symptoms, Frontiers in Plant Science, 5, 734.
[https://doi.org/10.3389/fpls.2014.00734]

-
Myung, I. S., Lee, J. Y., Yun, M. J., Lee, Y. H., Lee, Y. K., Park, D. H., Oh, C. S., 2016, Fire blight of apple, caused by Erwinia amylovora, a new disease in Korea, Plant Disease, 100(8), 1774-1774.
[https://doi.org/10.1094/PDIS-01-16-0024-PDN]

-
Oerke, E. C., Gerhards, R., Menz, G., Sikora, R. A., 2010, Precision crop protection-the challenge and use of heterogeneity, Vol. 5, Springer.
[https://doi.org/10.1007/978-90-481-9277-9]

-
Osuna-Caballero, S., Olivoto, T., Jiménez-Vaquero, M. A., Rubiales, D., Rispail, N., 2023, RGB image-based method for phenotyping rust disease progress in pea leaves using R, Plant Methods, 19(1), 86.
[https://doi.org/10.1186/s13007-023-01069-z]

- Park, D., Lee, Y. G., Kim, J. S., Cha, J. S., Oh, C. S., 2017, Current status of fire blight caused by Erwinia amylovora and action for its management in Korea, Journal of Plant Pathology, 59-63.
-
Park, I. W., Song, Y. R., Oh, E. J., Kim, Y., Hwang, I. S., Jeon, M. J., Ahn, C., Kim, J. S., Kim, S, Oh, C. S., 2023, Determination of fire blight susceptibility on wild rosaceae plants in Korea by artificial inoculation, Research in Plant Disease, 29(1), 23-38.
[https://doi.org/10.5423/RPD.2023.29.1.23]

-
Pérez-Bueno, M. L., Pineda, M., Barón, M., 2019, Phenotyping plant responses to biotic stress by chlorophyll fluorescence imaging, Frontiers in Plant Science, 10, 1135.
[https://doi.org/10.3389/fpls.2019.01135]

- R Core Team, 2021, R : A Language and environment for statistical computing, Version 4.1.2.
-
Ratner, B., 2009, The correlation coefficient: Its values range between+ 1/−1, or do they?, Journal of Targeting, Measurement and Analysis for Marketing, 17(2), 139-142.
[https://doi.org/10.1057/jt.2009.5]

-
Sankaran, S., Mishra, A., Ehsani, R., Davis, C., 2010, A Review of advanced techniques for detecting plant diseases, Computers and Electronics in Agriculture, 72(1), 1-13.
[https://doi.org/10.1016/j.compag.2010.02.007]

-
Sekulska-Nalewajko, J., Kornaś, A., Gocławski, J., Miszalski, Z., Kuźniak, E., 2019, Spatial referencing of chlorophyll fluorescence images for quantitative assessment of infection propagation in leaves demonstrated on the ice plant: Botrytis cinerea pathosystem, Plant Methods, 15, 1-15.
[https://doi.org/10.1186/s13007-019-0401-4]

-
Shen, L., Lin, X., Liu, F., Huang, Y., Ye, J., Tan, J., 2023, Early diagnosis of pine wood nematode disease based on chlorophyll fluorescence parameters and organic acids, Forests, 14(8), 1582.
[https://doi.org/10.3390/f14081582]

-
Shen, Y. F., Li, S. Q., 2011, Effects of the spatial coupling of water and fertilizer on the chlorophyll fluorescence parameters of winter wheat leaves, Agricultural Sciences in China, 10(12), 1923-1931.
[https://doi.org/10.1016/S1671-2927(11)60193-4]

-
Wang, G., Sun, Y., Wang, J., 2017, Automatic image‐based plant disease severity estimation using deep learning, Computational Intelligence and Neuroscience, 2017(1), 2917536.
[https://doi.org/10.1155/2017/2917536]

-
Xiao, D., Pan, Y., Feng, J., Yin, J., Liu, Y., He, L., 2022, Remote sensing detection algorithm for apple fire blight based on UAV multispectral image, Computers and Electronics in Agriculture, 199, 107-137.
[https://doi.org/10.1016/j.compag.2022.107137]

-
Yoo, S. Y., Eom, K. C., Park, S. H., Kim, T. W., 2012, Possibility of drought stress indexing by chlorophyll fluorescence imaging technique in Red Pepper (Capsicum annuum L.), Korean Society of Soil Science and Fertilizer, 45(5), 676-682.
[https://doi.org/10.7745/KJSSF.2012.45.5.676]

-
Yoo, S. Y., Park, S. H., Lee, M. J., Park, J. Y., Kang, H. G., Kang, S. K., Kim, T. W., 2015, Application of chlorophyll a fluorescence imaging analysis for selection of rapid frozen sweet persimmon fruits, Korean Journal of Environmental Agriculture, 34(3), 210-216.
[https://doi.org/10.5338/KJEA.2015.34.3.32]

- Zwet, T., Orolaza-Halbrendt, N., Zeller, W., 2012, Fire blight: History, biology, and management.
Department of Plant Resources and Landscape Architecture, Hankyong National Universityhybb0412@naver.com
Department of Plant Resources and Landscape Architecture, Hankyong National Universityymh5240@naver.com
Institute of Ecological Phytochemistry, Hankyong National Universitylsn136@hknu.ac.kr
Department of Environmental and Agricultural Research, Gyeonggi-do Agricultural Research and Extension Services cjy7165@gg.go.kr
Department of Plant Resources and Landscape Architecture, Hankyong National Universitytaewkim@hknu.ac.kr