
만성 사염화탄소 노출로 유발된 간 섬유증 마우스 모델에서 지방세포 사멸 억제를 통한 지방 및 간 섬유증 개선에 관한 연구
Ⓒ The Korean Environmental Sciences Society. All rights reserved.
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Liver fibrosis results from the build-up of collagen in the liver, initially acting as a healing mechanism; however, excessive accumulation progresses to liver cirrhosis, the advanced stage of liver disease. While numerous studies have been conducted to develop treatments to alleviate liver fibrosis, no effective therapeutic approaches are currently available. In research, carbon tetrachloride is commonly used to induce liver fibrosis because it generates reactive radicals that damage hepatic tissue and disrupt lipid metabolism, thereby intensifying inflammation and fibrosis. Adipose tissue, which is critical for energy storage, also contributes to toxin metabolism, where elevated CYP2E1 levels can lead to adipocyte death and exacerbate liver damage. Extensive research has shown that interactions between various organs are key to understanding the pathogenesis of liver diseases, with the relationship between the liver and adipose tissue being a particularly significant area of focus. Understanding the underlying mechanisms linking the progression of liver fibrosis and adipose tissue may provide valuable insights for identifying potential therapeutic targets. In this study, we explored the interactions between the liver and adipose tissue, focusing on the interplay involving the anti-apoptotic gene Bcl2 as a potential mediator in mitigating fibrotic progression.
Keywords:
Carbon tetrachloride, Liver fibrosis, Adipocyte death, Anti-apoptotic gene Bcl21. 서 론
간섬유화는 간에 반흔이 생기는 과정으로써, Extracellular matrix (ECM)와 같은 교원질의 침착으로 상처를 치유하는 과정이라고 할 수 있다. 하지만 과도하게 축적된 교원질은 간의 경도(Stiffness)를 증가시켜 간경화로 이어져, 간 기능의 구조적 구성에 영향을 주므로 간을 통한 혈류나 간기능의 문제가 발생한다. 특히 간이 과도한 교원질 침착으로 딱딱해지는 간경변으로 진행되면 간암의 위험성이 크게 증가되며, B형 바이러스 간염, 알코올성 간질환과 같은 기저질환은 대표적인 간섬유화을 악화시키는 원인으로 알려져 왔다(Zhang et al., 2016). 최근, 비만, 고혈압을 포함하는 대사성 질환이 빠르게 늘고 있는 선진국에서는 대사이상 관련 지방성간질환(Metabolic dysfunction-associated steatotic liver disease, MASLD)이 간섬유화의 주요한 원인으로 보고되고 있다(Heyens et al., 2021). 예를 들면, 실험동물을 이용하여 간섬유화의 발병 및 기전을 연구하기 위해 사염화탄소의 반복투여를 통한 간섬유화의 발병 및 그 기전 연구가 가장 활발하게 진행되고 있다. 체내에 흡수된 사염화탄소는 CYP2E1에 의해 CCl3・(Trichloromethyl radical) 및 CCl3OO・(Trichloromethyl peroxy radical)등 반응성이 큰 라디칼(Radical)로 대사되어 간지질을 구성하는 불포화 지방산을 라디칼화 시키고, 지질의 퍼옥실 라디칼(Peroxyl radical)의 생성을 촉진하여 지방간 및 간세포의 괴사를 유발시킨다(Scholten et al., 2015; Ravichandra and Schwabe, 2021). 특히, 사염화탄소의 급성 노출은 중심엽성 괴사(Centrilobular necrosis)를 유발하는 것으로 알려져 있지만, CYP2E1 활성을 저하시킨 동물은 사염화탄소에 의한 독성이 감소된다. CYP2E1의 과발현을 한 경우, 사염화탄소에 의한 간섬유화가 증가된다고 알려져 있다. 따라서 사염화탄소에 의해 지질단백질의 합성이 저해되어 중성지방이 VLDL (Very-low-density lipoprotein)의 형태로 전환되지 못해, 간세포밖으로의 방출이 어려워진다. 이러한 과정이 반복되어 지방간의 형성 및 간염(Hepatic inflammation)으로 발전할 뿐만 아니라, 간경화를 거쳐 간암으로 진행될 수 있다. 따라서, 간세포의 괴사, 지방간 및 간염을 포함한 폭넓은 병변은 사염화탄소의 투여를 통해 간섬유화를 유도시키는 실험동물모델을 가장 널리 이용하고 있다(Scholten et al., 2015).
지방조직(Adipose tissue)은 우리 몸에서 에너지 저장과 보호 기능을 담당하는 중요한 역할과 더불어, 지용성 독성물질을 흡수하고 보관할 수 있는 능력이 있다. 이는, 환경 오염 물질을 축적하여 체내에서 높은 농도의 독성물질을 유지할 수 있음을 시사한다. 다른 연구에 의하면, 지방조직에도 높은 수준의 CYP2E1이 발현하고 있어 다양한 독성물질의 생체내 변환(Biotransformation)을 유발하여, 알코올과 같은 독성물질에 의해 Adipocyte death 및 Lipolysis가 발생한다(Sebastian et al., 2011; Park et al., 2023). 본 연구는, 만성적으로 사염화탄소에 노출된 동물모델에서 간 및 지방조직에서의 섬유화를 확인하고, Anti-apoptosis 유전자인 Bcl2를 과발현시켜 Adipocyte death를 억제한 동물모델을 이용하여 간 및 지방조직의 섬유화 진행정도를 확인하고, 간섬유화와 지방조직과의 상호작용을 규명하는데 있다.
2. 재료 및 방법
2.1. 사염화탄소에 의한 간섬유화의 유도
사염화탄소를 12-14주령의 Wildtype (WT)와 Adipocyte specific Bcl2 TG (C57BL/6J background) 수컷 마우스에 주 2회 10% 사염화탄소를 Olive oil에 희석하여 복강내 주사를 시행하였다. 2개월(0.25 ml/kg 사염화탄소; 총 16회) 후, 마우스를 부검하여 혈청, 간, 그리고 지방 조직(Epidydimal, Subcutaneus adipose tissue)을 적출하였다. 또한, Adipocyte specific Bcl2 TG 마우스(Bcl2 AdipoTg)에도 8주간 사염화탄소를 투여하여 간과 지방의 섬유화 진행 정도를 평가하였다.
2.2. 혈청 분석 및 조직학적 분석
실험동물의 부검 당시 안구적출을 통해 혈액을 수집하고, 혈구 분석기를 이용하여 혈중 백혈구, 호중구 및 단핵구의 숫자를 평가하였다. 조직분석의 일관성을 높이기 위해서 간의 좌엽과 중간엽을 조직학적 분석에 이용하였으며, 지방조직의 경우는 좌측에서 분리한 Epidydimal fat(부고환지방)과 Subcutaneus fat(피하지방)만을 염색에 사용하였다. 분리한 조직은 10% 중성 포르말린에 넣어 고정을 시켜, Deparaffinization과 Rehydration 과정을 거쳐 조직 Processing을 완료한후, Paraffin-embedded tissue를 4 μm 두께로 박절하였다. 준비된 조직을 H&E염색과 Sirius red staining 실시한 후, 이를 광학 현미경을 이용하여 검경을 실시하였다.
2.3. RT-qPCR 분석
Total RNA를 TRIzol® (Thermo Fisher Scientific)을 이용하여 간조직과 지방조직으로부터 total RNA를 추출하고, total RNA는 qPCR RT master mix (Applied biosystems)를 이용하여 cDNA로 합성하였다. SYBR Green Real-time PCR Master Mix (Toyobo)를 이용해서 RT-qPCR을 실시하였으며, 모든 실험 결과는 Duplicated 되었다. mRNA의 발현은 b-actin으로 Normalize 한 후 결과를 분석하였다.
2.4. 통계학적 분석
데이터는 평균±SEM으로 표시하였다. 두 그룹 간의 Student's t test를 이용하여 대조군과 실험군간의 유의성을 평가하였으며, 모든 값은 5% 수준에서 평가하였다.
3. 결과 및 고찰
3.1. 만성 사염화탄소 노출에 의한 간 및 지방조직의 섬유화
C57BL/6J 수컷 마우스를 대상으로 8주간 사염화탄소를 복강내 투여를 통해 만성 간섬유화증을 유도하여(Fig. 1A) 만성적인 사염화탄소의 복강내 투여(8주)로 인해 Chicken wire라고 하는 Fibrotic septa의 형성이 Normal control 그룹과 비교하였을 때, 다수 관찰되는 등의 간섬유화가 상당부분 진행됨을 확인할 수 있었다(Fig. 1B). 흥미롭게도 8주에 걸쳐서 사염화탄소를 맞은 경우, 현저하게 위축된 지방조직을 육안으로 확인할 수 있었으며, Epididymal fat의 무게는 정상 마우스에 비해 약 1/3 정도로 현저하게 감소되어 있음을 관찰할 수 있었다(Fig. 1C). 또한, 분리한 Liver tissue, Subcutaneus fat, Epididymal fat으로부터 Fibrosis와 관련한 유전자의 발현을 평가하였을 때, Subcutaneus fat, Epididymal fat에서의 Liver fibrosis-associated gene의 발현이 간조직과 유사한 수준까지 증가되어 있음을 확인할 수 있었다. 특히, 통계학적 유의성은 관찰되지 않았지만, Epididymal fat에서의 섬유화 관련 유전자의 발현은 Subcutaneus fat보다 증가된 경향이 있음을 실험적으로 규명할 수 있었다(Fig. 1D). 만성 사염화탄소를 이용하여 간섬유화를 유도시킨 실험동물로부터 유래한 Subcutaneus fat, Epididymal fat을 이용하여 간섬유화의 정도를 확인할 수 있는 Sirius red staining을 실시하였을 때, 지방조직에서도 상당히 증가된 수준의 간섬유화의 진행을 확인할 수 있었을 뿐 아니라, 특히 Epididymal fat에서의 섬유화 진행은 Subcutaneous fat보다 현저하게 증가되어 있었다. 또한, Adipocyte death를 평가하기 위해 H&E 염색을 통한 Crown-like structure를 평가하였을 때도 Epididymal fat에서 현저히 증가된 Adipocyte death를 관찰할 수 있었다(Fig. 1E).
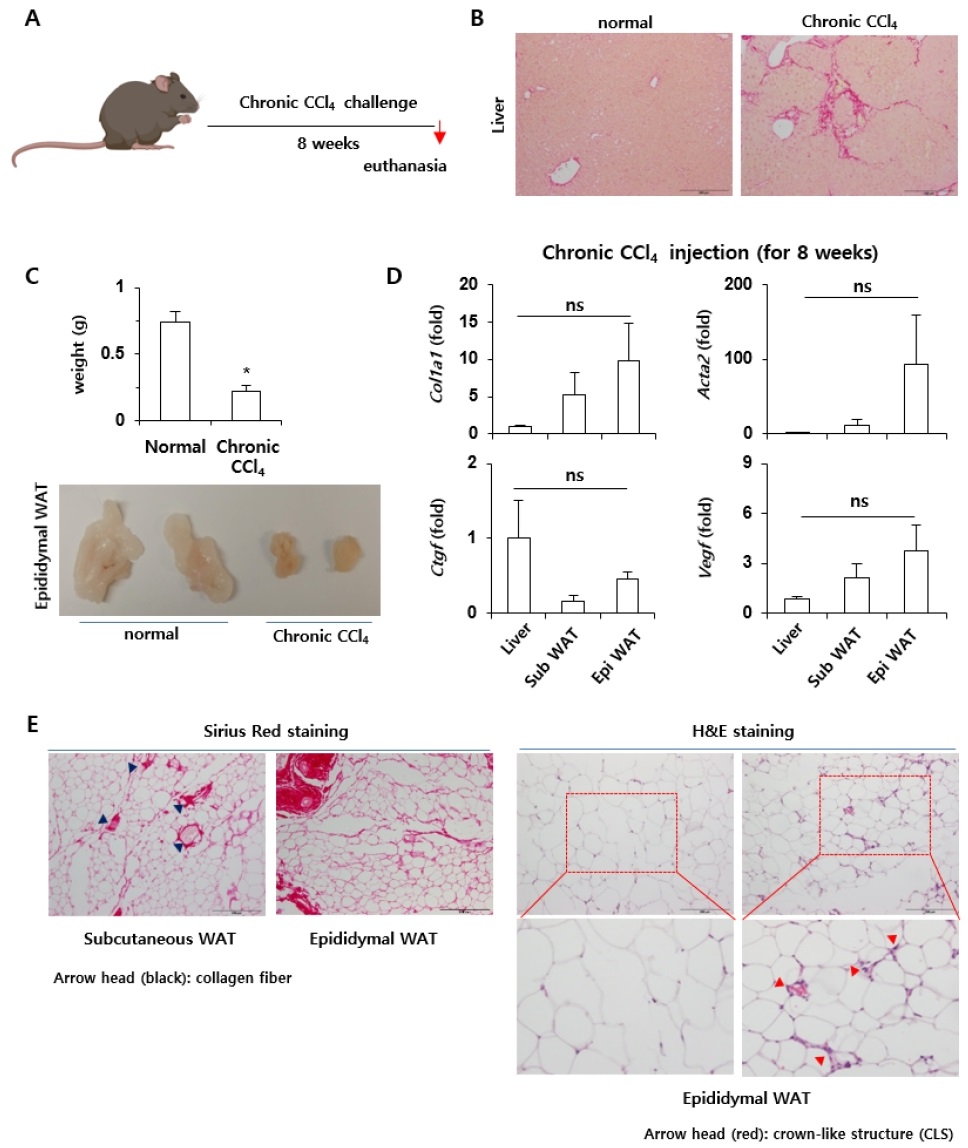
Development of fibrosis of the liver and adipose tissue due to chronic exposure to carbon tetrachloride. A, Schematic diagram of long-term carbon tetrachloride exposure to experimental animals; B, Microscopic observation of the degree of fibrosis through Sirius red staining of liver tissues; C, Gross changes and weight of adipose tissue after chronic carbon tetrachloride exposure; D, Liver tissue, subcutaneous fat, and epididymal fat were subjected to RT-qPCR analysis; E, Subcutaneous fat and epididymal fat tissues were subjected to Sirius Red and H&E stainings.
알코올, 독성물질, 고지방식이와 같은 다양한 외부 자극에 의해 손상을 받은 간은 지방간, 지방간염과 같은 병리적 현상을 거치면서 교원질이 생성되는 간섬유화가 일어나게 되며, 더욱 만성화되어 고착화될 경우 비가역적인 간경화 또는 간암으로까지 진행되기도 한다(Zhang et al., 2016). 또한, 인간에서의 간섬유화의 발병 기전을 이해하기 위해서는 반드시 인간의 질병과 유사한 동물모델이 필요한데, 현재 동물에서의 간섬유화의 유도에 관해서는 사람과 유사한 동물 모델은 개발되어 있지 않다(Liu et al., 2013; Scholten et al., 2015). 따라서 다양한 간섬유화 동물 모델이 활용되고 있으며, 그중 사염화탄소를 이용한 간섬유화의 유도가 현재까지 가장 널리 이용되어 온 방법이다. 특히, 사염화탄소에 의한 간손상 및 간의 섬유화는 Cytochrome P450 (CYP)의 Isozyme을 유도하는 물질들에 의해 간세포의 손상이 증가하는 것으로 잘 알려져 있다(Fujii et al., 2010). 지금까지 사염화탄소는 주로 간독성을 유발하는 물질로 알려져 왔으며, 지방조직에 대한 사염화탄소의 독성 영향에 대한 직접적인 연구는 현재까지 제한적이다. 따라서, 본 연구 결과는 만성 사염화탄소에 의한 간섬유화의 진행이 간과 지방조직인 Epididymal fat에도 현저한 영향을 끼쳐서 지방조직에서의 섬유화 및 Adipocyte death까지 진행된다는 사실을 실험적으로 규명하였다는 의의가 있다.
3.2. Adipocyte death의 조절을 통한 간섬유화의 진행억제
특히, 체내 지방조직 인 Epididymal fat에서의 Adipocyte death 및 섬유화가 높은 수준으로 발생했다는 점은 독성물질인 사염화탄소가 간 및 다른 장기에도 높은 수준으로 영향을 끼침을 확인할 수 있었다. 사염화탄소의 지방에 대한 직접적인 영향을 보다 명확히 확인하기 위하여, Anti-apoptosis에 관여하는 Bcl2 유전자를 과발현시켜 지방세포의 사멸(Adipocyte death)를 억제하는 마우스 모델로서 Bcl2AdipoTg 마우스를 이용하였다. 앞 실험과 동일하게 C57BL/6J WT과 Bcl2AdipoTg 마우스에 사염화탄소를 이용한 간섬유화를 유도하여 분리한 전혈을 이용한 혈구 분석은 두 그룹사이에는 백혈구, 호중구, 단핵구의 차이는 확인되지는 않았다(Fig. 2A). 하지만, 간에서 분리한 Polymorphonuclear cells (PMNC)를 이용하여 FACS 분석한 결과 Adipocyte death를 억제한 동물모델에서 간으로 침윤되는 호중구의 숫자가 현저하게 줄어듬을 확인할 수 있었다(Fig. 2B). 더불어 간과 지방조직에서 섬유화의 진행 역시 현저하게 감소되는 것을 실험적으로 규명할 수 있었다(Fig. 2C). 이러한 결과를 뒷받침하기 위해 간과 지방조직(Epididymal fat)을 이용하여 RT-qPCR을 실시하였으며, Fibrosis-associated gene과 지방조직에서의 lipolysis와 연관된 유전자의 발현이 Bcl2AdipoTg 마우스에서 감소되어 있음을 실험적으로 규명할 수 있었다(Fig. 2D).
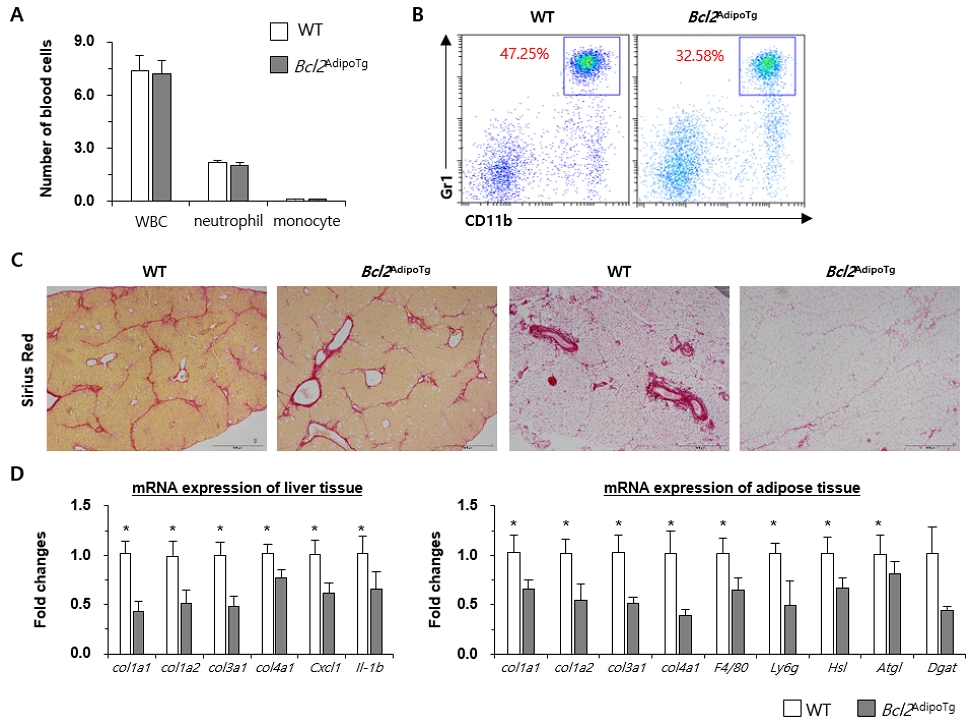
Inhibition of adipocyte death ameliorates the progression of liver fibrosis. A, Complete blood cell counts were performed; B, Isolated PMNC from liver tissue were analyzed using FACS analysis; C, Sirius red staining was performed using liver tissue and epididymal fat tissues; D, Total RNA was extracted from liver tissue and fat tissue and RT-qPCR was performed.
지방조직은 우리 몸에서 에너지를 저장하고 보호하는 역할 뿐 아니라, 지용성 독성 물질의 흡수/저장할 수 있기에 다양한 환경 오염 물질을 축적하여 체내에서 높은 농도의 독성 물질을 유지하게 된다. 지방조직에서도 cytochrome P450의 Isozyme, 특히 CYP2E1이 높게 발현하고 있기 때문에 최근 단순히 에너지 저장의 기능뿐 아니라(Aubert at al., 2011), Biotransformation이라는 맥락에서도 지방의 기능 및 역할에 대해 많은 연구가 이뤄지고 있다(Sebastian et al., 2011). 또한, 최근 연구에 따르면 폭음과 같이 고농도로 유입한 독성물질이 Adipocyte death 및 Lipolysis를 유도시키며 이 과정에서 유리된 Free fatty acids가 Portal vein을 통해 간으로 이동하여 간손상을 더욱 야기시킨다고 알려져 있다(Kim at al., 2019; Park at al., 2023). 본 연구를 통해 장기간 사염화탄소를 통해 고도의 간섬유화를 야기시킨 모델에서 흥미롭게도 Epididymal fat에서도 증가된 섬유화 및 Adipocyte death를 확인할 수 있었으며, 이는 체내에 흡수된 사염화탄소의 일부가 지방조직에서 Biotransformation이 일어나며 세포독성 및 섬유화를 유발한 것으로 볼 수 있다. Adipose tissue-liver axis의 맥락에서 Adipocyte death를 억제하는 Bcl2 transgenic mouse (Bcl2 AdipoTg mouse)를 이용하여 사염화탄소에 의한 간섬유화를 유도하였을 때, Adipocyte death의 조절은 속발적으로 간섬유화의 진행과 매우 밀접한 연관이 있음을 증명하였다. 이를 통해 Multiple organ의 Cross-communication의 가능성을 규명할 수 있었다.
4. 결 론
본 연구는 만성 사염화탄소에 노출된 동물모델에서의 간 및 지방조직에서의 섬유화와 Anti-apoptosis 유전자인 Bcl2를 과발현하여 Adipocyte death를 억제한 동물모델을 이용하여 간 및 지방조직의 섬유화 진행 정도를 파악 후 섬유화와 지방조직과의 상호작용을 규명하는데 있다. Adipose tissue-liver axis의 맥락에서 Adipocyte death를 억제하는 Bcl2 transgenic mouse (Bcl2AdipoTgmouse)를 이용하여 사염화탄소에 의한 간섬유화 유도를 실시하였다. 그 결과를 보면 장기간 사염화탄소를 통해 고도의 간섬유화를 야기시킨 모델에서 흥미롭게도 Epididymal fat에서도 증가된 섬유화 및 Adipocyte death를 확인할 수 있었다. 체내에 흡수된 사염화탄소의 일부가 지방조직에서 Biotransformation이 일어나며 세포독성 및 섬유화를 유발한 것으로 볼 수 있다. 또한, Bcl2 transgenic 마우스는 지방조직의 섬유화가 감소되었을 뿐만 아니라, 간의 섬유화의 진행 역시 WT과 비교했을 때보다 현저하게 저하되었음을 확인할 수 있었다. 이러한 결과를 바탕으로 지방조직의 Adipocyte death를 억제하였을 때 만성 간질환의 진행까지 영향을 미치며, 이를 통해 Multiple organ의 Cross-communication을 이해하는 것이 매우 중요함을 시사한다. 또한, 본 연구의 결과로부터 간섬유화와 지방조직과의 상호작용 후속 연구에서 기초자료를 제공할 수 있다.
REFERENCES
-
Aubert, J., Begriche, K., Knockaert, L., Robin, M. A., Fromenty, B., 2011, Increased expression of cytochrome P450 2E1 in nonalcoholic fatty liver disease: Mechanisms and pathophysiological role, Clin. Res. Hepatol. Gastroenterol., 35, 630-637.
[https://doi.org/10.1016/j.clinre.2011.04.015]

-
Fujii, T., Fuchs, B. C., Yamada, S., Lauwers, G. Y., Kulu, Y., Goodwin, J. M. et al., 2010, Mouse model of carbon tetrachloride induced liver fibrosis: Histopathological changes and expression of CD133 and epidermal growth factor, BMC Gastroenterol., 10(79), 1-11.
[https://doi.org/10.1186/1471-230X-10-79]

-
Heyens, L. J. M., Busschots, D., Koek, G. H., Robaeys, G., Francque, S., 2021, Liver fibrosis in non-alcoholic fatty liver disease: From liver biopsy to non-invasive biomarkers in diagnosis and treatment, Front. Med. (Lausanne), 8, 615-978.
[https://doi.org/10.3389/fmed.2021.615978]

-
Kim, S. J., Feng, D., Guillot, A., Dai, S., Liu, F., Hwang, S. et al., 2019, Adipocyte death preferentially induces liver injury and inflammation through the activation of chemokine (C-C Motif) receptor 2-positive macrophages and lipolysis, Hepatology, 69, 1965-1982.
[https://doi.org/10.1002/hep.30525]

-
Liu, Y., Meyer, C., Xu, C., Weng, H., Hellerbrand, C., Dijke, P., Dooley, S., 2013, Animal models of chronic liver diseases, Am. J. Physiol. Gastrointest. Liver Physiol., 304, G449-468.
[https://doi.org/10.1152/ajpgi.00199.2012]

-
Park, S. H., Seo, W., Xu, M. J., Mackowiak, B., Lin, Y., He, Y. et al., 2023, Ethanol and its nonoxidative metabolites promote acute liver injury by inducing ER stress, Adipocyte Death, and Lipolysis. Cell. Mol. Gastroenterol. Hepatol., 15, 281-306.
[https://doi.org/10.1016/j.jcmgh.2022.10.002]

-
Ravichandra, A., Schwabe, R. F., 2021, Mouse models of liver fibrosis, Methods Mol. Biol., 2299, 339-356.
[https://doi.org/10.1007/978-1-0716-1382-5_23]

-
Scholten, D., Trebicka, J., Liedtke, C., Weiskirchen, R., 2015, The carbon tetrachloride model in mice, Lab. Anim., 49, 4-11.
[https://doi.org/10.1177/0023677215571192]

-
Sebastian, B. M., Roychowdhury, S., Tang, H., Hillian, A. D., Feldstein, A. E., Stahl, G. L. et al., 2011, Identification of a cytochrome P4502E1/Bid/C1q-dependent axis mediating inflammation in adipose tissue after chronic ethanol feeding to mice, J. Biol. Chem., 286, 35989-35997.
[https://doi.org/10.1074/jbc.M111.254201]

-
Zhang, C. Y., Yuan, W. G., He, P., Lei, J. H., Wang, C. X., 2016, Liver fibrosis and hepatic stellate cells: Etiology, pathological hallmarks and therapeutic targets, World J. Gastroenterol., 22, 10512-10522.
[https://doi.org/10.3748/wjg.v22.i48.10512]

Department of Companion Animal Health, Hanyang Women’s Universitypeanutjellycookies@gmail.com